النموذج الذري لمسلمات دالتون
ال نموذج دالتون الذري أو نظرية دالتون الذرية, لقد كان اقتراحًا تم تقديمه بين عامي 1803 و 1807 من قبل العالم الكيميائي والرياضيات جون دالتون. كان هذا هو الاقتراح الأول للتنظيم المفاهيمي فيما يتعلق بهيكل الذرات وعملها.
يُعرف نموذج دالتون أيضًا بأنه نموذج كروي ، لأنه يقترح حقيقة أن الذرة عبارة عن كرة صلبة وغير قابلة للتجزئة. بفضل هذا النموذج ، كان من الأسهل بكثير تقديم شرح حول الكيمياء لبقية العالم وكان الأساس للعديد من المشاريع البحثية المبتكرة التي تلت ذلك. يمكن أن يفسر سبب تفاعل المواد في بعض الدول.
وفقا لدالتون ، كانت المادة تتألف من وحدة دنيا تسمى الذرة ، والتي لا يمكن تدميرها أو تقسيمها بأي شكل من الأشكال. كانت هذه الوحدة ، التي اقترحها Democritus سابقًا ومعلمه Leucipo ، أساسًا لأبحاث Dalton وإنشاء نموذجه الذري.
مع هذه النظرية الذرية ، حاول جون دالتون تناول أفكار الفلاسفة اليونانيين حول وجود الذرة (النظرية الذرية للكون) ، ولكن باستخدام منصة التجارب المختلفة المخبرية التي سمحت له لإظهار أفكاره.
مؤشر
- 1 المسلمات من نموذج دالتون الذري
- 1.1 الافتراض 1
- 1.2 الافتراض 2
- 1.3 الافتراض 3
- 1.4 الافتراض 4
- 1.5 الافتراض 5
- 1.6 الافتراض 6
- 2 أخطاء نموذج دالتون الذري
- 2.1 صيغة الماء
- 2.2 تركيب الذرات
- 3 استنتاجات
- 4 مساهمات دالتون الرئيسية
- 4.1 سلائف النظريات الذرية
- 4.2 وضع أسس الكيمياء الحديثة
- 4.3 أولاً نشر جدول للأوزان الكيميائية
- 4.4 أعطِ الاسم لعمى الألوان
- 5 مواد ذات أهمية
- 6 المراجع
مسلمات نموذج دالتون الذري
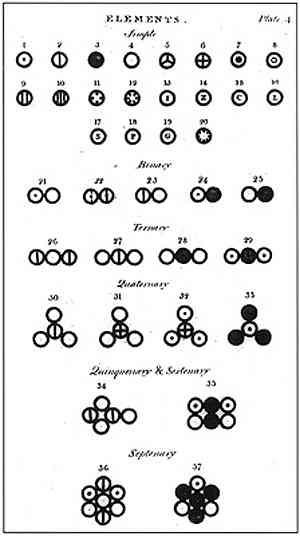
قام دالتون بصياغة نموذجه الذري بستة افتراضات يشرح فيها كيف أسس دراساته وكيف قام بها.
افترض 1

في الصورة أعلاه ، يتم تقديم ملخص لنموذج دالتون: ستكون الذرات كرات صغيرة غير قابلة للتجزئة وغير قابلة للتجزئة ومتجانسة.
ذكرت أول فرضية دالتون أن العناصر تتكون من جزيئات صغيرة تسمى الذرات ، والتي لا يمكن تقسيمها ولا يمكن تدميرها.
أيضا ، علق دالتون أن هذه الجسيمات لا يمكن أن تتغير في أي تفاعل كيميائي.
افترض 2

ثبتت الافتراض الثاني لدالتون أن جميع الذرات الموجودة في نفس العنصر متساوية في الوزن كما في الخصائص الأخرى.
من ناحية أخرى ، أثبتت أيضًا أن ذرات العناصر المختلفة لها كتلة مختلفة. من هذا الاقتراح نشأت معرفة الأوزان الذرية النسبية التي تم إظهارها عند مقارنة العناصر المختلفة مع الهيدروجين.
افترض 3

ثبتت الفرضية الثالثة لدالتون أن الذرات غير قابلة للتجزئة حتى عندما يتم دمجها في التفاعلات الكيميائية. ولا يمكن إنشاؤها أو تدميرها.
توليفة الذرات ، متساوية ومختلفة ، تولد مركبات أكثر تعقيدًا ، لكن هذه العملية لن تغير حقيقة أن الذرة هي الحد الأدنى لوحدة المادة.
افترض 4
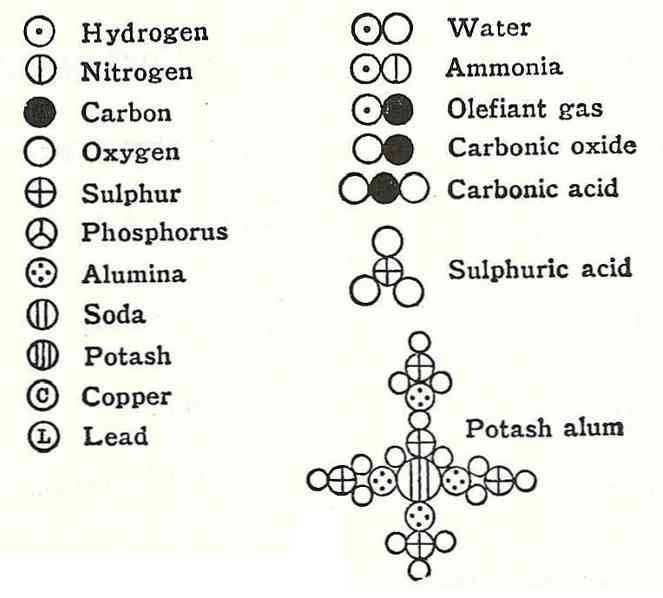
ثبتت الافتراض الرابع لدالتون أنه حتى عندما يتم دمج الذرات لتشكيل مركب ، سيكون لها دائمًا علاقة يمكن التعبير عنها بأعداد بسيطة وكاملة. لن يظهر هذا التعبير في الكسور ، لأن الذرات غير قابلة للتجزئة.
افترض 5
ذكرت افتراض دالتون الخامس أن هناك مزيجًا ممكنًا من الذرات المختلفة بنسب مختلفة لتشكيل أكثر من مركب واحد.
بهذه الطريقة ، يمكن تفسير أنه من خلال كمية محدودة من الذرات ، أصبحت كل المواد الموجودة في الكون.
افترض 6
ذكرت فرضية دالتون السادسة والأخيرة أن كل مركب كيميائي تم إنشاؤه من مزيج من ذرات عنصرين مختلفين أو أكثر.
أخطاء نموذج دالتون الذري
مثل كل النظريات في عالم العلوم ، كان هناك العديد من التفنيد فيما يتعلق بالنموذج الذي اقترحه دالتون ، والذي تم عرضه على مر السنين تاركًا وراءه أفكار دالتون المبتكرة.
صيغة الماء
مثال على ذلك الحجة التي قدمها دالتون حول صيغة الماء ، والتي قال إنها كانت تتألف من الهيدروجين والأكسجين.
بسبب هذا البيان ، كان هناك العديد من الأخطاء في الحساب فيما يتعلق بوزن ووزن بعض المركبات الأساسية التي كانت تستند إلى تلك المعلومات.
بعد بضع سنوات ، دحض العلماء الأوروبيون غاي لوساك وألكساندر فون هومبود هذه المعلومات وأثبتوا أن الماء يتكون بالفعل من هيدروجينين وأكسجين واحد. بعد 6 سنوات أشار Amadeo Avogadro إلى التكوين الدقيق للمياه وبسبب ذلك يوجد قانون Avogadro.
تكوين الذرات
من ناحية أخرى ، في القرن العشرين تم الكشف عن التكوين الحقيقي للذرات. في هذه الحالة تبين أن هناك وحدة أصغر مثل البروتونات والإلكترونات والنيوترونات.
وبالمثل ، ظهر وجود الأوزان الذرية المختلفة المحددة في الجدول الدوري لمندليف وماير ، ووجود نظائر وخصائص كيميائية أكثر تحديدًا..
الاستنتاجات
على الرغم من أخطائه ، كانت مساهمات جون دالتون ذات أهمية كبيرة في عالم العلوم وتسببت في ضجة في وقته بسبب كمية المعلومات الكبيرة التي قدمها.
مساهماتك العلمية لا تزال صالحة وما زالت قيد الدراسة.
لم يتم استنطاق النموذج الذري لدالتون لعقود من الزمان بسبب أهميته في عالم العلوم وتفسيره الصحيح للتحقيقات والفرضيات التي تم تقديمها في تلك اللحظة من تاريخ العلم.
مساهمات دالتون الرئيسية
كانت مساهمته في عالم العلوم أساسًا في توضيح وصياغة الفرضيات حول الطبيعة من خلال الاختبارات الكمية.
توفي العالم إثر نوبة قلبية في 27 يوليو 1884 في مانشستر وبعد فترة وجيزة من تلقي مرتبة الشرف من الملكية.
سلائف النظريات الذرية
كان جون دالتون الكيميائي الإنجليزية ، عالم الرياضيات والصيدلي. وُلِد في السادس من سبتمبر عام 1766 في كمبرلاند بالمملكة المتحدة ، ويُعرف بأنه أحد سلائف النظريات الذرية منذ اللحظة التي قدم فيها نموذجه الذري..
لقد وضع أسس الكيمياء الحديثة
يُعرف دالتون كواحد من رواد صناعة الأوزان النسبية للعناصر الكيميائية. ساعدت هذه الحقيقة في وضع الأسس لما نعرفه اليوم باسم الكيمياء الحديثة.
أول من نشر جدول الأوزان الكيميائية
كان دالتون أول عالم يشرفه نشر جدول للأوزان الذرية شمل عناصر مثل الهيدروجين والأكسجين والفوسفور والكربون والكبريت. بفضل هذا المنشور بدأ دالتون العمل وصياغة ما سيكون نموذجه الذري.
إعطاء اسم لعمى الألوان
تجدر الإشارة إلى أن دالتون كان من أوائل الأشخاص الذين سجلوا مشاكل بصرية لالتقاط الألوان وبسبب هذا الشرط ، سميت هذه الحالة باسم عمى الألوان.
المواد المثيرة للاهتمام
النموذج الذري لشرودنجر.
النموذج الذري لبرولي.
النموذج الذري لتشادويك.
النموذج الذري لهيسنبرغ.
النموذج الذري لبيرين.
النموذج الذري لطومسون.
النموذج الذري لديراك الأردن.
النموذج الذري للديموقريطس.
النموذج الذري لبهر.
مراجع
- نظرية دالتون الذرية. تم الاسترجاع في 24 نوفمبر 2017 ، من Khanacademy: www.khanacademy.org
- نظرية دالتون الذرية. تم الاسترجاع في 24 نوفمبر 2017 ، من جامعة إنديانا الشمالية الغربية: iun.edu
- النظرية الذرية. تم الاسترجاع في 24 نوفمبر 2017 ، من Encyclopædia Britannica: www.britannica.com
- النظرية الذرية. تم الاسترجاع في 24 نوفمبر 2017 ، من ويكيبيديا: en.wikipedia.org
- تاريخ التركيب الذري. تم الاسترجاع في 24 نوفمبر 2017 ، من Lumen: courses.lumenlearning.com.


