مجال الكيمياء البيئية للدراسة والتطبيقات
ال كيمياء بيئية يدرس العمليات الكيميائية التي تحدث على المستوى البيئي. إنه علم يطبق المبادئ الكيميائية على دراسة الأداء البيئي والآثار الناتجة عن الأنشطة البشرية.
بالإضافة إلى ذلك ، تصمم الكيمياء البيئية أساليب الوقاية والتخفيف والعلاج للأضرار البيئية الحالية.
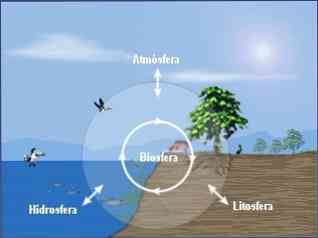
يمكن تقسيم الكيمياء البيئية إلى ثلاثة تخصصات أساسية هي:
- الكيمياء البيئية للغلاف الجوي.
- الكيمياء البيئية للغلاف المائي.
- كيمياء التربة البيئية.
يتطلب النهج الشامل للكيمياء البيئية أيضًا دراسة العلاقات المتبادلة بين العمليات الكيميائية التي تحدث في هذه الأجزاء الثلاثة (الغلاف الجوي ، الغلاف المائي ، التربة) وعلاقاتها مع المحيط الحيوي.
مؤشر
- 1 الكيمياء البيئية للغلاف الجوي
- 1.1-الستراتوسفير
- 1.2-التروبوسفير
- 2 الكيمياء البيئية للغلاف المائي
- 2.1 - المياه العذبة
- 2.2 - دورة المياه
- 2.3 - الآثار الأنثروبولوجية على دورة المياه
- 3 كيمياء التربة البيئية
- 3.1 التربة
- 3.2 الآثار الأنثروبولوجية على التربة
- 4 العلاقة بين البيئة الكيميائية
- 4.1-النموذجي Garrels و Lerman
- 5 تطبيقات الكيمياء البيئية
- 6 المراجع
الكيمياء البيئية للغلاف الجوي
الغلاف الجوي هو طبقة الغازات التي تحيط بالأرض ؛ إنه نظام معقد للغاية ، حيث درجات الحرارة والضغط والتركيب الكيميائي تختلف مع الارتفاع في نطاقات واسعة جدا.
الشمس تقصف الغلاف الجوي بالإشعاع وجزيئات الطاقة العالية ؛ هذه الحقيقة لها آثار كيميائية مهمة للغاية في جميع طبقات الغلاف الجوي ، ولكن على وجه الخصوص ، في الطبقات العليا والخارجية.
-الستراتوسفير
تحدث تفاعلات التفكك الضوئي والضوء في المناطق الخارجية للغلاف الجوي. في المنطقة التي يتراوح ارتفاعها بين 30 و 90 كيلومتراً تقاس من سطح الأرض ، في طبقة الستراتوسفير ، توجد طبقة تحتوي على معظم الأوزون (أو3) ، ودعا طبقة الأوزون.
طبقة الاوزون
الأوزون يمتص الأشعة فوق البنفسجية عالية الطاقة التي تأتي من الشمس وإذا لم يكن لوجود هذه الطبقة ، لا توجد طريقة معروفة للحياة على هذا الكوكب ، يمكن أن تعيش.
في عام 1995 ، فاز الكيميائيون في الغلاف الجوي ماريو ج. مولينا (المكسيكي) ، فرانك س..
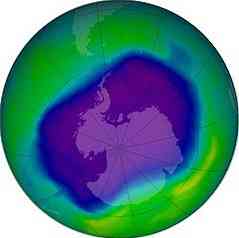
في عام 1970 ، أظهر كروتسن أن أكاسيد النيتروجين تدمر الأوزون من خلال التفاعلات الكيميائية الحفزية. بعد ذلك ، أظهرت مولينا ورولاند في عام 1974 أن كلور مركبات الكربون الكلورية فلورية قادر أيضًا على تدمير طبقة الأوزون..
-التروبوسفير
تتكون الطبقة الجوية فوق سطح الأرض مباشرة ، والتي يتراوح ارتفاعها بين 0 و 12 كم ، والتي تسمى التروبوسفير ، من النيتروجين (N)2) والأكسجين (O2).
الغازات السامة
نتيجة للأنشطة البشرية ، يحتوي التروبوسفير على العديد من المواد الكيميائية الإضافية التي تعتبر ملوثات للهواء ، مثل:
- ثاني أكسيد الكربون وأول أكسيد الكربون (CO2 و CO).
- الميثان (CH4).
- أكسيد النيتروجين (لا).
- ثاني أكسيد الكبريت (SO)2).
- الأوزون يا3 (يعتبر ملوثا في التروبوسفير)
- المركبات العضوية المتطايرة (VOC's) ، المساحيق أو الجزيئات الصلبة.
من بين العديد من المواد الأخرى التي تؤثر على صحة الإنسان والنبات والحيوان.
المطر الحمضي
أكاسيد الكبريت2 و SO3) والنيتروجين مثل أكسيد النيتروز (NO2) ، تسبب مشكلة بيئية أخرى تسمى الأمطار الحمضية.
تتفاعل هذه الأكاسيد ، الموجودة في التروبوسفير بشكل رئيسي كمنتجات لاحتراق الوقود الأحفوري في الأنشطة الصناعية والنقل ، مع حامض الكبريتيك الذي ينتج مياه الأمطار وحامض النتريك ، مما يؤدي إلى ترسبات الحمض.
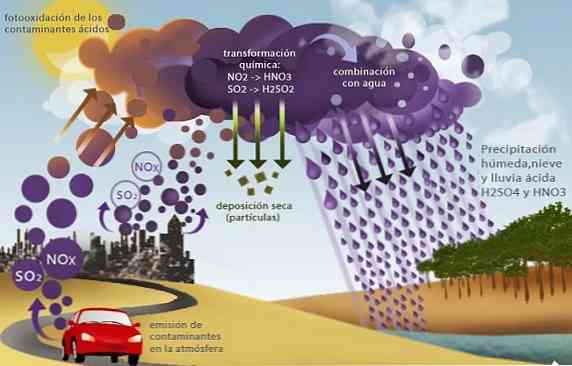
عن طريق ترسيب المطر الذي يحتوي على أحماض قوية ، فإنه يسبب العديد من المشاكل البيئية مثل تحمض البحار والمياه العذبة. هذا يسبب وفاة الكائنات المائية ؛ تحمض التربة التي تسبب موت المحاصيل وتدميرها بفعل التآكل الكيميائي للمباني والجسور والمعالم الأثرية.
المشاكل البيئية الأخرى في الغلاف الجوي هي الضباب الدخاني الكيميائي الضوئي ، الذي يسببه أكاسيد النيتروجين والأوزون التروبوسفيري
الاحتباس الحراري
الاحترار العالمي ينتج عن تركيزات عالية من ثاني أكسيد الكربون2 غازات الدفيئة في الغلاف الجوي وغيرها من غازات الدفيئة التي تمتص الكثير من الأشعة تحت الحمراء المنبعثة من سطح الأرض وتحبس الحرارة في التروبوسفير. هذا يولد تغير المناخ على هذا الكوكب.
الكيمياء البيئية للغلاف المائي
يتوافق hydrósfera بواسطة جميع المسطحات المائية للأرض: سطحية أو رطوب - المحيطات والبحيرات والأنهار والينابيع - وتحت الأرض أو طبقات المياه الجوفية.
-الماء العذب
الماء هو المادة السائلة الأكثر شيوعًا على الكوكب ، ويغطي 75٪ من سطح الأرض وهو ضروري للغاية للحياة.
تعتمد جميع أشكال الحياة على المياه العذبة (تُعرف بأنها ماء به نسبة ملح أقل من 0.01٪) 97 ٪ من مياه الكوكب هي المياه المالحة.
من 3 ٪ المتبقية من المياه العذبة ، 87 ٪ في:
- أقطاب الأرض (التي تذوب وتصب في البحار بسبب الاحتباس الحراري).
- الأنهار الجليدية (أيضا في عملية الاختفاء).
- المياه الجوفية.
- الماء على شكل بخار موجود في الغلاف الجوي.
فقط 0.4 ٪ من إجمالي المياه العذبة في العالم متاحة للاستهلاك. يوفر تبخر الماء من المحيطات وهطول الأمطار باستمرار هذه النسبة المئوية الصغيرة.
تقوم الكيمياء البيئية للمياه بدراسة العمليات الكيميائية التي تحدث في دورة المياه أو الدورة الهيدرولوجية وأيضًا تطوير تقنيات لتنقية المياه للاستهلاك البشري ومعالجة مياه الصرف الصناعية والحضرية وتحلية مياه البحر وإعادة التدوير وحفظ هذا المورد ، من بين أمور أخرى.
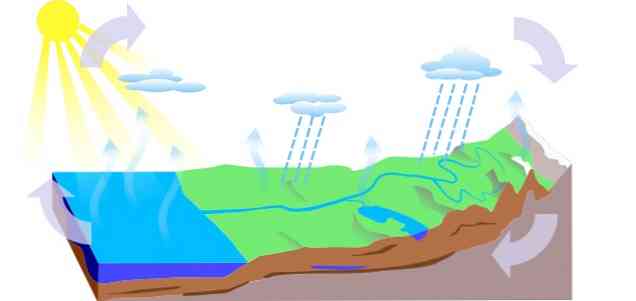
-دورة المياه
تتكون دورة المياه على الأرض من ثلاث عمليات رئيسية: التبخر والتكثيف والهطول ، والتي تستمد منها ثلاث دوائر:
- الجريان السطحي
- التبخر من النباتات
- التسلل ، الذي يمر فيه الماء إلى مستويات تحت الأرض (المياه الجوفية) ، يدور عبر قنوات طبقة المياه الجوفية ويخرج من الينابيع أو الينابيع أو الآبار.
-الآثار الأنثروبولوجية على دورة المياه
النشاط البشري له تأثير على دورة المياه ؛ بعض أسباب وآثار العمل الأنثروبولوجي هي كما يلي:
تعديل سطح الأرض
يتم إنشاؤه عن طريق تدمير الغابات والحقول مع إزالة الغابات. يؤثر هذا على دورة المياه عن طريق القضاء على التبخر (نقل المياه عبر النباتات والعودة إلى البيئة من خلال النتح والتبخر) وزيادة الجريان السطحي.
تؤدي زيادة الجريان السطحي إلى زيادة تدفق النهر والفيضانات.
يعدل التحضر أيضًا سطح الأرض ويؤثر على دورة المياه ، حيث يتم استبدال التربة المسامية بالإسمنت والأسفلت غير المنفَّذ ، مما يجعل التسلل مستحيلًا.
تلوث دورة المياه
تتضمن دورة المياه المحيط الحيوي بأكمله ، وبالتالي فإن النفايات الناتجة عن الكائن البشري ، يتم دمجها في هذه الدورة من خلال عمليات مختلفة.
يتم دمج الملوثات الكيميائية في الهواء في المطر. المواد الكيميائية الزراعية المطبقة على التربة ، وتعاني المادة المرتشحة والتسلل إلى طبقات المياه الجوفية ، أو الجري في الأنهار والبحيرات والبحار.
كما يتم سحب هدر الدهون والزيوت ورشوة مكبات النفايات عن طريق التسلل إلى المياه الجوفية.
استخراج إمدادات المياه مع السحب على المكشوف في الموارد المائية
هذه الممارسات مع السحب على المكشوف ، وتنتج نضوب المياه الجوفية واحتياطي المياه السطحية ، تؤثر على النظم الإيكولوجية وتنتج هبوط التربة المحلية.
كيمياء التربة البيئية
التربة هي واحدة من أهم العوامل في توازن المحيط الحيوي. أنها توفر مرسى والمياه والمواد المغذية للنباتات ، والتي هي المنتجين في السلاسل الغذائية الأرضية.
الكلمة
يمكن تعريف التربة باعتبارها نظامًا بيئيًا معقدًا وديناميكيًا يتكون من ثلاث مراحل: مرحلة صلبة من الدعم المعدني والعضوي ، ومرحلة سائلة مائية وطور غاز ؛ تتميز بوجود حيوانات ونباتات معينة (البكتيريا والفطريات والفيروسات والنباتات والحشرات والديدان الخيطية والبروتوزوا).
تتغير خصائص التربة باستمرار بسبب الظروف البيئية والنشاط البيولوجي الذي يتطور فيها..
الآثار الأنثروبولوجية على الأرض
تدهور التربة هو عملية تقلل من القدرة الإنتاجية للتربة ، قادرة على إحداث تغيير عميق وسالب في النظام البيئي.
العوامل التي تنتج تدهور التربة هي: المناخ ، علم وظائف الأعضاء ، علم الأحجار ، الغطاء النباتي والعمل البشري.

عن طريق العمل البشري يمكن أن يحدث:
- التدهور المادي للتربة (على سبيل المثال ، الانضغاط بسبب الممارسات الزراعية والحيوانية غير الكافية).
- التدهور الكيميائي للتربة (التحمض ، القلوية ، التمليح ، التلوث بالكيماويات الزراعية ، النفايات السائلة الناتجة عن النشاط الصناعي والحضري ، انسكابات النفط ، وغيرها).
- تدهور التربة البيولوجي (انخفاض في محتوى المادة العضوية ، وتدهور الغطاء النباتي ، وفقدان الكائنات الحية الدقيقة المثبتة للنيتروجين ، وغيرها).
العلاقة بين البيئة الكيميائية
تدرس الكيمياء البيئية العمليات الكيميائية المختلفة التي تحدث في الأجزاء البيئية الثلاثة: الغلاف الجوي والغلاف المائي والتربة. من المثير للاهتمام مراجعة التركيز الإضافي على نموذج كيميائي بسيط ، والذي يحاول شرح عمليات النقل العالمية للمادة التي تحدث في البيئة.
-نموذج Garders وليرمان
طوّر جاريلز وليرمان (1981) نموذجًا مبسطًا للكيمياء الجيولوجية الحيوية لسطح الأرض ، والذي يدرس التفاعلات بين الغلاف الجوي والغلاف المائي وقشرة الأرض ومقصورات المحيط الحيوي المشمولة..
يعتبر نموذج جاريلز وليرمان سبعة معادن أساسية في الكوكب:
- الجص (CaSO4)
- البايرايت2)
- كربونات الكالسيوم3)
- كربونات المغنسيوم (MgCO3)
- سيليكات المغنسيوم (MgSiO3)
- أكسيد الحديديك2O3)
- ثاني أكسيد السيليكون (SiO)2)
يتم تمثيل المادة العضوية التي تشكل المحيط الحيوي (سواء الأحياء والأموات) ، على أنها CH2أو ، وهو التكوين التقريبي للأنسجة الحية للأنسجة الحية.
في نموذج جاريلز وليرمان ، تتم دراسة التغيرات الجيولوجية على أنها عمليات نقل صافية للمادة بين هذه المكونات الثمانية للكوكب ، من خلال التفاعلات الكيميائية وتوازن صافي للحفاظ على الكتلة..
تراكم CO2 في الجو
على سبيل المثال ، مشكلة تراكم CO2 في هذا الغلاف ، تمت دراسة هذا النموذج قائلًا: في الوقت الحالي ، نحرق الكربون العضوي المخزن في المحيط الحيوي مثل الفحم والنفط والغاز الطبيعي المودعين في باطن الأرض في الأوقات الجيولوجية الماضية.
نتيجة لهذا الاحتراق المكثف للوقود الأحفوري ، تركيز CO2 الغلاف الجوي آخذ في الازدياد.
الزيادة في تركيزات ثاني أكسيد الكربون2 في الغلاف الجوي للأرض ، لأن معدل احتراق الكربون الأحفوري يتجاوز معدل امتصاص الكربون بواسطة المكونات الأخرى للنظام الكيميائي الأحيائي للأرض (مثل الكائنات العضوية الضوئية والغلاف المائي ، على سبيل المثال).
في هذه الطريقة ، انبعاث CO2 إلى الغلاف الجوي بسبب الأنشطة البشرية ، يتجاوز النظام التنظيمي الذي يعدل التغييرات على الأرض.
حجم المحيط الحيوي
يعتبر النموذج الذي طورته جاريلز وليرمان أن حجم المحيط الحيوي يزيد وينقص نتيجة التوازن بين التمثيل الضوئي والتنفس..
خلال تاريخ الحياة على الأرض ، زادت كتلة المحيط الحيوي على مراحل مع ارتفاع معدلات التمثيل الضوئي. نتج عن ذلك تخزين صافٍ للكربون العضوي وانبعاث الأكسجين:
CO2 + H2يا → CH2O + O2
التنفس كنشاط أيضي للكائنات الحية الدقيقة والحيوانات الأعلى ، يحول الكربون العضوي إلى ثاني أكسيد الكربون (CO2) والمياه (ح2O) ، وهذا هو ، يعكس التفاعل الكيميائي السابق.
يعد وجود الماء وتخزين الكربون العضوي وإنتاج الأكسجين الجزيئي من العوامل الأساسية لوجود الحياة.
تطبيقات الكيمياء البيئية
تقدم الكيمياء البيئية حلولًا لمنع وتخفيف وعلاج الأضرار البيئية الناجمة عن النشاط البشري. من بين بعض هذه الحلول يمكن أن نذكر:
- تصميم مواد جديدة تسمى MOF's (اختصارًا باللغة الإنجليزية: الأطر المعدنية العضوية). هذه مسامية للغاية ولديها القدرة على: امتصاص ثاني أكسيد الكربون والاحتفاظ به2, الحصول على H2أو بخار الهواء من المناطق الصحراوية وتخزين H2 في حاويات صغيرة.
- تحويل النفايات إلى مواد خام. على سبيل المثال ، استخدام الإطارات البالية في إنتاج العشب الصناعي أو باطن الأحذية. أيضا استخدام النفايات تشذيب المحاصيل ، في توليد الغاز الحيوي أو الإيثانول الحيوي.
- التركيب الكيميائي لبدائل مركبات الكربون الكلورية فلورية.
- تطوير طاقات بديلة ، مثل خلايا الهيدروجين ، لتوليد الكهرباء النظيفة.
- السيطرة على التلوث الجوي ، مع مرشحات خاملة والمرشحات التفاعلية.
- تحلية مياه البحر بالتناضح العكسي.
- تطوير مواد جديدة لتلقيح المواد الغروية المعلقة في الماء (عملية التنقية).
- عودة التخثث في البحيرات.
- تطوير "الكيمياء الخضراء" ، وهو الاتجاه الذي يقترح استبدال المركبات الكيميائية السامة بمركبات أقل سمية ، والإجراءات الكيميائية "الصديقة للبيئة". على سبيل المثال ، يتم تطبيقه في استخدام المذيبات والمواد السامة أقل ، في الصناعة ، في التنظيف الجاف للمغاسل ، من بين أمور أخرى..
مراجع
- Calvert، J.، Lazrus، A.، Kok، G.L.، Heikes، B.G.، Walega، J.G.، Lind، J.، and Cantrell، C.A (1985). الآليات الكيميائية لتوليد الحمض في التروبوسفير. Nature ، 317 (6032) ، 27-35. Doi: 10.1038 / 317027a0.
- كروتسن ، ص. (1970). تأثير أكاسيد النيتروجين على المحتوى الجوي. Q.J.R. أرصاد الجوية: بالنسبة. سوس وايلي بلاكويل. 96: 320-325.
- جاريلز ، آر إم و Lerman، A. (1981). دورات الفانيروزويك من الكربون الرسوبي والكبريت. وقائع الأكاديمية الطبيعية للعلوم. U.S.A. 78: 4،652-4،656.
- Hester، R. E. and Harrison، R. M. (2002). التغير البيئي العالمي. الجمعية الملكية للكيمياء. ص 205.
- Hites، R. A. (2007). عناصر الكيمياء البيئية. ايلي INTERSCIENCE. ص 215.
- مانهان ، س. إ. (2000). الكيمياء البيئية. الطبعة السابعة. CRC. ص 876
- مولينا ، م. و Rowland ، F.S. (1974). بالوعة الستراتوسفير للكلوروفلوروميثان: تدمير الكلور لذرة الأوزون. الطبيعة. 249: 810-812.
- موريل ، إف إم و هيرينغ (2000). مبادئ وتطبيقات الكيمياء المائية. نيويورك: جون وايلي.
- Stockwell، W. R.، Lawson، C.V.، Saunders، E.، and Goliff، W. S. (2011). مراجعة للكيمياء التروبوسفيرية للغلاف الجوي والآليات الكيميائية لمرحلة الغاز لنمذجة جودة الهواء. الغلاف الجوي ، 3 (1) ، 1-32. Doi: 10.3390 / atmos3010001


