موازنة طرق المعادلات الكيميائية والأمثلة
ال موازنة المعادلات الكيميائية يعني أن جميع العناصر الموجودة في المعادلة المذكورة لها نفس عدد الذرات في كل جانب. لتحقيق ذلك ، من الضروري استخدام طرق الموازنة لتعيين معاملات العناصر المتكافئة المناسبة لكل الأنواع الموجودة في التفاعل.
المعادلة الكيميائية هي تمثيل ما يحدث أثناء التفاعل الكيميائي بين مادتين أو أكثر عن طريق الرموز. تتفاعل المواد المتفاعلة مع بعضها البعض ، ووفقًا لظروف التفاعل ، سيتم الحصول على واحد أو أكثر من المركبات المختلفة كمنتج..
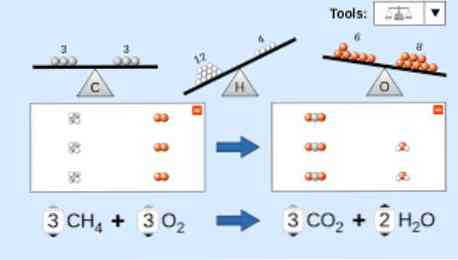
عند وصف المعادلة الكيميائية ، يجب مراعاة ما يلي: أولاً ، يتم كتابة المواد المتفاعلة على الجانب الأيسر من المعادلة ، متبوعة بسهم أحادي الاتجاه أو سهمين أفقيين متعاكسين ، اعتمادًا على نوع التفاعل الذي يتم تنفيذه. الرأس.
مؤشر
- 1 طرق موازنة المعادلات الكيميائية
- 1.1 توازن المعادلات الكيميائية بالتجربة والخطأ (يطلق عليه أيضًا الفحص أو التجربة)
- 1.2 التوازن الجبري للمعادلات الكيميائية
- 1.3 المتداول معادلات الأكسدة (طريقة الأيونات الإلكترونية)
- 2 أمثلة على موازنة المعادلات الكيميائية
- 2.1 المثال الأول
- 2.2 المثال الثاني
- 2.3 المثال الثالث
- 3 المراجع
طرق موازنة المعادلات الكيميائية
مع الأخذ في الاعتبار أن العناصر المتفاعلة والمنتجات معروفة ، وأن صيغها يتم التعبير عنها بشكل صحيح على الجانب المقابل لها ، فإننا نواصل موازنة المعادلات وفقًا للطرق التالية.
موازنة المعادلات الكيميائية بالتجربة والخطأ (وتسمى أيضًا بالتفتيش أو التجربة)
يعتمد على توازن العناصر المتفاعلة في التفاعل ويحاول تجربة معاملات مختلفة من أجل موازنة المعادلة ، طالما يتم اختيار أصغر عدد صحيح ممكن يتم الحصول على نفس عدد ذرات كل عنصر فيه على كلا الجانبين من رد الفعل.
معامل المفاعل أو المنتج هو الرقم الذي يسبق صيغته ، وهو الرقم الوحيد الذي يمكن تغييره عند موازنة المعادلة ، حيث أن تغيير اشتراكات الصيغ قد يغير هوية المركب في السؤال.
عد ومقارنة
بعد تحديد كل عنصر من عناصر التفاعل ووضعه على الجانب الصحيح ، ننتقل إلى حساب ومقارنة عدد ذرات كل عنصر موجود في المعادلة وتحديد تلك التي يجب موازنتها.
بعد ذلك ، نواصل موازنة كل عنصر (واحد في كل مرة) ، عن طريق وضع معاملات كاملة تسبق كل صيغة تحتوي على عناصر غير متوازنة. عادة ما تكون العناصر المعدنية متوازنة أولاً ، ثم العناصر غير المعدنية وأخيراً ذرات الأكسجين والهيدروجين.
بهذه الطريقة ، يضاعف كل معامل كل ذرات الصيغة السابقة ؛ لذلك أثناء موازنة عنصر ما يمكن للآخرين عدم التوازن ، ولكن يتم تصحيح هذا لأن رد الفعل متوازن.
أخيرًا ، يتم إثباتها من خلال إحصاء أخير بأن المعادلة بأكملها متوازنة بشكل صحيح ، أي أنها تطيع قانون حفظ المادة.
موازنة جبرية للمعادلات الكيميائية
لاستخدام هذه الطريقة ، يتم وضع إجراء لمعالجة معاملات المعادلات الكيميائية على أنها مجهولة في النظام يجب حلها..
أولاً ، يتم أخذ عنصر معين من التفاعل كمرجع وتوضع المعاملات كأحرف (أ ، ب ، ج ، د ...) ، والتي تمثل المجهول ، وفقًا لذرات هذا العنصر الموجودة في كل جزيء (إذا كان لا يحتوي النوع على أن العنصر يوضع "0").
بعد الحصول على هذه المعادلة الأولى ، يتم تحديد معادلات العناصر الأخرى الموجودة في التفاعل ؛ سيكون هناك العديد من المعادلات كما توجد عناصر في رد الفعل المذكور.
أخيرًا ، يتم تحديد المجهول بإحدى الطرق الجبرية للتخفيض أو المعادلة أو الاستبدال ويتم الحصول على المعاملات التي تؤدي إلى معادلة متوازنة بشكل صحيح.
موازنة معادلات الأكسدة (طريقة الأيونات الإلكترونية)
أولاً ، يتم وضع رد الفعل العام (غير المتوازن) في شكله الأيوني. ثم تنقسم هذه المعادلة إلى نصفين تفاعلين ، الأكسدة والاختزال ، كل موازنة حسب عدد الذرات ونوعها وشحناتها.
على سبيل المثال ، بالنسبة إلى التفاعلات التي تحدث في الوسط الحمضي ، تتم إضافة جزيئات H.2أو لتحقيق التوازن بين ذرات الأكسجين وإضافة H+ لتحقيق التوازن بين ذرات الهيدروجين.
في المقابل ، في وسط قلوي يتم إضافة عدد متساوٍ من أيونات OH- على جانبي المعادلة لكل H ion+, وحيث تنشأ أيونات H+ و OH- يجتمعون معا لتشكيل جزيئات H2O.
أضف الإلكترونات
ثم يجب عليك إضافة أكبر عدد ممكن من الإلكترونات لموازنة الشحنات ، بعد موازنة الأمر في كل رد فعل نصف.
بعد التدحرج لكل نصف تفاعل ، تتم إضافتها وتوجت بموازنة المعادلة النهائية بالتجربة والخطأ. في حالة وجود اختلاف في عدد الإلكترونات الخاصة بنصفين من التفاعلات ، يجب ضرب واحد أو كليهما بمعامل يساوي هذا العدد.
أخيرًا ، يجب التأكيد على أن المعادلة تتضمن نفس عدد الذرات ونفس النوع من الذرات ، بالإضافة إلى وجود نفس الشحنات على جانبي المعادلة العالمية.
أمثلة على موازنة المعادلات الكيميائية
المثال الأول
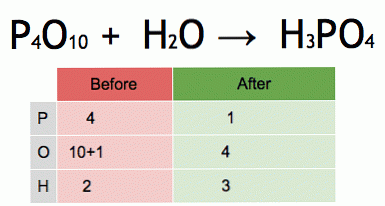
هذه هي الرسوم المتحركة لمعادلة كيميائية متوازنة. يتم تحويل خامس أكسيد الفوسفور والماء إلى حامض الفسفوريك.
P4O10 + 6 H2O → 4 H3PO4 (-177 kJ).
المثال الثاني
لديك رد فعل الاحتراق من الإيثان (غير متوازن).
C2H6 + O2 → شركة2 + H2O
باستخدام طريقة التجربة والخطأ لموازنتها ، يلاحظ أن أيا من العناصر لديه نفس العدد من الذرات على جانبي المعادلة. وبالتالي ، فإنه يبدأ بتوازن الكربون ، مع إضافة اثنين كمعامل كيميائي مترافق مع جانب المنتجات.
C2H6 + O2 → 2CO2 + H2O
تم موازنة الكربون على كلا الجانبين ، لذلك نحن نواصل تحقيق التوازن بين الهيدروجين بإضافة ثلاثة إلى جزيء الماء.
C2H6 + O2 → 2CO2 + 3H2O
أخيرًا ، نظرًا لوجود سبع ذرات أكسجين على الجانب الأيمن من المعادلة وهي العنصر الأخير الذي لا يزال يتعين موازنته ، يتم وضع الرقم الكسري 7/2 أمام جزيء الأكسجين (على الرغم من تفضيل المعاملات الكاملة عمومًا).
C2H6 + 7 / 2O2 → 2CO2 + 3H2O
ثم تحقق من وجود عدد مماثل من ذرات الكربون (2) والهيدروجين (6) والأكسجين (7) على كل جانب من المعادلة.
المثال الثالث
يحدث أكسدة الحديد بواسطة أيونات ديكرومات في وسط حامض (غير متوازن وفي شكله الأيوني).
إيمان2+ + كر2O72- الإيمان3+ + كر3+
باستخدام طريقة الإلكترون الأيوني لتحقيق التوازن ، تنقسم إلى تفاعلين نصفين.
الأكسدة: الإيمان2+ الإيمان3+
التخفيض: كر2O72- → كر3+
نظرًا لأن ذرات الحديد متوازنة بالفعل (1: 1) ، تتم إضافة إلكترون على جانب المنتجات لموازنة الشحنة.
إيمان2+ الإيمان3+ + و-
الآن تتوازن ذرات Cr ، مما يضيف اثنتين إلى الجانب الأيمن من المعادلة. ثم ، عندما يحدث التفاعل في وسط الحمض ، تتم إضافة سبعة جزيئات من H.2أو على جانب المنتجات لموازنة ذرات الأكسجين.
كر2O72- → 2Cr3+ + 7H2O
لتحقيق التوازن بين ذرات H ، يتم إضافة 14 أيونات H+ على جانب المواد المتفاعلة ، وبعد موازنة المادة ، تتم موازنة الشحنات بإضافة ستة إلكترونات على نفس الجانب.
كر2O72- +14H+ + 6E- → 2Cr3+ + 7H2O
أخيرًا ، تتم إضافة كل من تفاعلات النصف ، ولكن نظرًا لوجود إلكترون واحد فقط في تفاعل الأكسدة ، يجب مضاعفة كل ذلك بستة.
6Fe2+ + كر2O72- +14H+ + 6E- الإيمان3+ + 2CH3+ + 7H2O + 6e-
أخيرًا ، يجب القضاء على الإلكترونات على كلا الجانبين من المعادلة الأيونية العالمية ، والتحقق من أن شحنتها والمادة متوازنة بشكل صحيح.
مراجع
- تشانغ ، ر. (2007). الكيمياء. (الطبعة التاسعة). ماكجرو هيل.
- Hein، M.، and Arena، S. (2010). أسس كلية الكيمياء ، البديل. تم الاسترجاع من books.google.co.ve
- Tuli، G. D.، and Soni، P. L. (2016). لغة الكيمياء أو المعادلات الكيميائية. تم الاسترجاع من books.google.co.ve
- النشر السريع (2015). معادلات الكيمياء وإجاباتها (أدلة الدراسة السريعة). تم الاسترجاع من books.google.co.ve


