خصائص ثاني كرومات الصوديوم ، والإنتاج ، والمخاطر والاستخدامات
ال ثاني كرومات الصوديوم هو مركب غير عضوي من الصيغة Na2Cr2O7. وهو واحد من العديد من مركبات الكروم سداسي التكافؤ (الكروم السادس). الشكل 1 مبين في الشكل 1 ، على الرغم من أن الملح عادةً ما يتم معالجته في شكله المجفف الذي تكون صيغته Na2Cr2O7 · H2O.
له ارتباطان أيوني بين جزيئات الصوديوم والأكسجين المشحون سالبًا. يتم استخراج خام الكروم من ثاني كرومات الصوديوم. يتم إنتاج ملايين الكيلوغرامات من ثاني كرومات الصوديوم سنويًا.
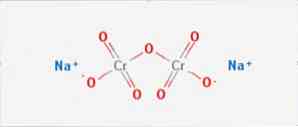
تعد الصين أكبر منتج لثاني كرومات الصوديوم ، لكن إنتاج المصانع الكيميائية الصينية منخفض نسبيًا ، حيث يقل إنتاج كل منها عن 50000 طن سنويًا ، مقارنة بمصنع كازاخستان الذي ينتج أكثر من 100000 طن سنويًا.
يبلغ إنتاج النباتات في روسيا والولايات المتحدة والمملكة المتحدة ما بين 50000 و 100000 طن سنويًا (Kogel ، 2006).
فيما يتعلق بالتفاعلية والمظهر ، فإن ثنائي كرومات الصوديوم له خصائص مماثلة لثاني كرومات البوتاسيوم ، ومع ذلك ، فإن ملح الصوديوم أكثر قابلية للذوبان في الماء ويبلغ وزنه أقل من ملح البوتاسيوم.
ينتج ثاني كرومات الصوديوم أبخرة كروم سامة عند تسخينها. إنه عامل مؤكسد قوي وهو شديد التآكل.
يمكن العثور على هذا المركب في مصادر مياه الشرب الملوثة بعمليات صناعية مختلفة مثل تقنيات الجلفنة أو الطلاء الكهربائي ، ودباغة الجلود وصناعة النسيج..
مؤشر
- 1 الخصائص الفيزيائية والكيميائية
- 2 طرق الإنتاج
- 3 التفاعل والمخاطر
- 4 الاستخدامات والتطبيقات
- 5 الكيمياء الحيوية
- 6 المراجع
الخصائص الفيزيائية والكيميائية
يتكون ثنائي كرومات الصوديوم من بلورات ذات هيكل أحادي اللون البرتقالي المحمر في شكلها اللامائي والرائحة. وزنه الجزيئي هو 261.97 جم / مول في شكله اللامائي و 298.00 جم / مول في شكله المجفف.
تبلغ درجة انصهارها 356.7 درجة مئوية ، ونقطة الغليان 400 درجة مئوية والتي تتحلل فيها. لها كثافة 2.52 جم / مل.

ويبين الشكل 2 ظهور ثاني كرومات الصوديوم. تبلغ قابلية ذوبانه في الماء 187 جم لكل 100 جرام بمعدل 25 درجة مئوية ، وقابلية ذوبانه في الإيثانول 513.2 جرام لكل لتر عند 19.4 درجة مئوية (المركز الوطني لمعلومات التكنولوجيا الحيوية ، ص.ف).
يعتبر مركبًا مستقرًا إذا تم تخزينه تحت الظروف الموصى بها وغير قابل للاشتعال. نظرًا لأنه عامل مؤكسد قوي ، فهو عامل تآكل ، وفيه يكون للحمض القدرة على خفض الرقم الهيدروجيني إلى 4 في محلول بنسبة 1٪ وزن / حجم.
طرق الإنتاج
يمكن تحويل كرومات الصوديوم إلى ثاني كرومات من خلال عملية مستمرة تتعامل مع حمض الكبريتيك وثاني أكسيد الكربون أو مزيج من هذين.
يؤدي تبخر سائل ثاني كرومات الصوديوم إلى تساقط كبريتات الصوديوم و / أو بيكربونات الصوديوم ، وتتم إزالة هذه المركبات قبل التبلور النهائي لثاني كرومات الصوديوم..
يمكن عمل ثاني كرومات الصوديوم في عملية من ثلاث خطوات:
- تحميص القلوية لظروف أكسدة الكروميت
- الرشح. استخلاص المادة القابلة للذوبان من الخليط عن طريق عمل مذيب سائل
- تحويل أحادي كرومات الصوديوم في ثاني كرومات الصوديوم عن طريق الحمض.
يمكن تحضير ثنائي كرومات الصوديوم اللامائي عن طريق إذابة ثنائي هيدرات الصوديوم ، أو بلورة محاليل ثنائي كرومات الصوديوم فوق 86 درجة مئوية ، أو تجفيف محاليل ثنائي كرومات الصوديوم في مجففات الرش.
يتم استخدام محاليل ثنائي كرومات الصوديوم عند 69 و 70٪ وزن / حجم كوسيلة مريحة وفعالة من حيث التكلفة لإرسال الكميات ، وتجنب الحاجة إلى المعالجة اليدوية أو تفكيك البلورات.
التفاعل والمخاطر
إنه عامل مؤكسد قوي. غير متوافق مع الأحماض القوية. الاتصال مع المواد القابلة للاحتراق يمكن أن يسبب الحرائق. يمكن تشكيل الأبخرة السامة لأكسيد الكروم في وجود حرارة أو نار.
"خليط حامض الكروميك" المعروف من ثنائي كرومات وحمض الكبريتيك مع المخلفات العضوية يؤدي إلى رد فعل طارد للحرارة. هذا الخليط في تركيبة مع بقايا الأسيتون يؤدي أيضا إلى رد فعل عنيف.
مزيج من ثنائي كرومات وحمض الكبريتيك مع الكحول ، والإيثانول والبروبانول ، يؤدي إلى رد فعل طارد للحرارة. بسبب حدوث العديد من الحوادث التي تنطوي على خلط حمض ثنائي كرومات حامض الكبريتيك مع المواد العضوية المؤكسدة ، فمن الأفضل تجنب مثل هذه التفاعلات.
مزيج من ثنائي كرومات مع هيدرازين متفجر ، ويمكن توقع أن يكون رد فعل ثنائي كرومات قويًا مع الأمينات بشكل عام. تؤدي إضافة ملح ثنائي كرومات المجفف إلى أنهيدريد الخل إلى تفاعل طارد للحرارة شديد الانفجار.
البورون والسيليكون وثنائي كرومات تشكيل مخاليط الألعاب النارية. مزيج من حمض الأسيتيك ، 2-ميثيل -2-بنتنال وثنائي كرومات يؤدي إلى تفاعل متفشي (ورقة البيانات الكيميائية الصوديوم ثنائي كرومات. ، 2016).
استنشاق الغبار أو الضباب يسبب تهيج الجهاز التنفسي الذي يشبه في بعض الأحيان الربو. قد يحدث ثقب ثقب. ويعتبر السم.
يسبب الابتلاع القيء والإسهال ومضاعفات المعدة والكلى بشكل غير عادي. ملامسة العينين أو الجلد يسبب تهيج موضعي. التعرض المتكرر للجلد يسبب التهاب الجلد.
ثاني كرومات الصوديوم مادة مسرطنة عند البشر. هناك أدلة على أن مركبات الكروم سداسي التكافؤ أو الكروم (سادسا) يمكن أن تسبب سرطان الرئة لدى البشر. لقد ثبت أن ثاني كرومات الصوديوم يسبب سرطان الرئة لدى الحيوانات.
على الرغم من أن ثنائي كرومات الصوديوم لم يتم تحديده كمركب ماسخ أو خطر تكاثر ، فمن المعروف أن مركبات الكروم سداسي التكافؤ أو الكروم (سادسا) هي ماسخة وتسبب أضرارا إنجابية مثل الحد من الخصوبة والتدخل في دورات الحيض.
يمكن أن يتسبب ثنائي كرومات الصوديوم في تلف الكبد والكلى ، لذا يجب إدارته بعناية شديدة (قسم الصحة في نيو جيرسي ، 2009).
في حالة الابتلاع ، يجب على الضحية شرب الماء أو الحليب ؛ لا تحفز القيء. في حالة ملامسة الجلد أو العينين ، ينبغي علاجه كحروق حمضية ؛ شطف عينيك بالماء لمدة 15 دقيقة على الأقل.
يمكن فرك الآفات الخارجية بمحلول 2٪ من ثيوسلفات الصوديوم. في جميع الحالات ، يجب استشارة الطبيب.
يستخدم والتطبيقات
بصرف النظر عن أهميتها في تصنيع مواد كيميائية أخرى من الكروم ، فإن لكرومات الصوديوم أيضًا العديد من الاستخدامات المباشرة كمكون في إنتاج:
- النهاية المعدنية: تساعد على مقاومة التآكل وتنظيف الأسطح المعدنية ، كما تفضل التصاق الطلاء.
- المنتجات العضوية: تستخدم كعوامل مؤكسدة في صناعة منتجات مثل فيتامين K والشمع.
- أصباغ: تستخدم في صناعة أصباغ كرومات غير عضوية حيث تنتج مجموعة من الألوان مستقرة للضوء. كما تستخدم بعض درجات الكرومات كمثبطات للتآكل في الطبقات السفلية والاشعال.
- السيراميك: يستخدم في إعداد النظارات الملونة والزجاج الخزفي.
- النسيج: يستخدم كمصدر للاصباغ الحمضية لتحسين خصائصه السريعة التلوين.
- إنتاج كبريتات الكروم.
(ثاني كرومات الصوديوم ، لبنة البناء لجميع مركبات الكروم الأخرى تقريبًا ، 2010-2012)
ثنائي كرومات الصوديوم ثنائي الهيدرات ، استخدامه مثالي في ظروف مختلفة بما في ذلك تطبيقات درجات الحرارة العالية ، مثل الزجاج المزجج والزجاج الملون.
يعتبر أكسيد الكروم ، الذي يكون أصعب من أكاسيد المعادن الأخرى ، مثل التيتانيوم أو الحديد ، مثاليًا للبيئات التي تكون فيها درجة الحرارة وظروف العملية عدوانية.
تستخدم هذه المادة أساسًا لإنتاج مركبات الكروم الأخرى ، ولكنها تستخدم أيضًا في طين البنتونيت المستخدم في إنتاج النفط والمواد الحافظة للأخشاب وفي إنتاج المواد الكيميائية العضوية ومثبط للتآكل..
عند مزجه مع الألومنيوم وثاني كرومات البوتاسيوم ، باستخدام عملية الألومينو الحرارية ، فإن أكسيد الكروم ينتج كروم معدني عالي النقاء. هذا عنصر حيوي في إنتاج السبائك الفائقة عالية الأداء المستخدمة في صناعة الطيران.
في التخليق العضوي ، يستخدم ثنائي كرومات الصوديوم كعامل مؤكسد في تفاعلات أكسيد الحد في وجود حمض الكبريتيك.
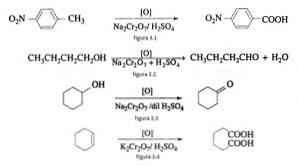
على سبيل المثال ، أكسدة p- نتروتولوين لتشكيل حمض p-nitrobenzoic ، في أكسدة n-بيوتانول لتكوين n-butaldehyde ، في تكوين cyclohexanone من cyclohexanol وتشكيل حمض adipic كما هو موضح في الأشكال و 3.2 و 3.3 و 3.4 على التوالي (VK Ahluwalia ، 2004).
كيمياء حيوية
أدى تقطير داخل الرغامى لثاني كرومات الصوديوم (CrVI) وهيدروكسيد أسيتات الكروم (CrIII) في ذكور الفئران إلى زيادة تركيزات الكروم في الدم الكامل والبلازما والبول لمدة تصل إلى 72 ساعة بعد التعرض ؛ تم الوصول إلى التركيزات القصوى في 6 ساعات بعد التعرض.
كانت النسبة بين تركيزات كروم الدم والكروم في الدم مختلفة اختلافًا كبيرًا في علاجات Cr (VI) و Cr (III). لذلك ، ينبغي استخدام تحليلات الكروم في الدم والكروم في البلازما لتقييم التعرض للكروم.
تم اكتشاف الكروم أيضًا في الخلايا اللمفاوية المحيطية. كروم (سادسا) ، ولكن ليس كروم (الثالث) المتراكمة بشكل كبير في الخلايا اللمفاوية بعد العلاج. هذه الخلايا لديها القدرة على استخدامها كمؤشرات حيوية في تقييم التعرض لمركبات الكروم (Hooth، 2008).
مراجع
- ورقة البيانات الكيميائية ثاني كرومات الصوديوم. (2016). تم استرجاعها من المواد الكيميائية النقش: cameochemicals.noaa.
- Hooth، M. J. (2008). تقرير فني عن دراسات السموم والتسرطن من ثنائي كرومات الصوديوم المجفف. المعهد الوطني للصحة بالولايات المتحدة الأمريكية.
- Kogel، J. E. (2006). المعادن والصخور الصناعية: السلع والأسواق ، واستخدامات الطبعة السابعة. ليتلتون كولورادو: مجتمع التعدين والمعادن والتعدين المؤتمر الوطني العراقي.
- المركز الوطني لمعلومات التكنولوجيا الحيوية. (بدون تاريخ). قاعدة بيانات PubChem المركبة ؛ إدارة البحث الجنائي = 25408. تم الاسترجاع من pubchem.com: pubchem.ncbi.nlm.nih.gov.
- نيو جيرسي وزارة الصحة. (2009 ، نوفمبر). مادة الحقائق الخطرة ورقة ديكرومات الصوديوم. تم الاسترجاع من nj.gov: nj.gov.
- ثاني كرومات الصوديوم. لبنة البناء لجميع مركبات الكروم الأخرى. (2010-2012). تم الاسترجاع من elementis chromium: elementischromium.com
- ك. أهلواليا ، ر. أ. (2004). الكيمياء العضوية العملية الشاملة: المستحضرات والتحاليل الكمية. دلهي: مطبعة الجامعة (الهند).


