طاقة التنشيط الكيميائي
ال طاقة التنشيط الكيميائي (من وجهة نظر الدراسات الحركية) يشير إلى أقل كمية ممكنة من الطاقة اللازمة لبدء التفاعل الكيميائي. وفقا لنظرية الاصطدامات في الحركية الكيميائية ، يقال أن جميع الجزيئات التي تتحرك لها كمية معينة من الطاقة الحركية.
هذا يعني أنه كلما زادت سرعة حركتك ، زاد حجم الطاقة الحركية لديك. في هذا المعنى ، لا يمكن تقسيم جزيء يحمل حركة سريعة إلى شظايا في حد ذاته ، لذلك يجب أن يحدث تصادم بينها وبين جزيء آخر حتى يحدث تفاعل كيميائي.
عندما يحدث هذا - عندما يحدث تصادم بين الجزيئات - يتحول جزء من طاقتها الحركية إلى طاقة اهتزازية. وبالمثل ، إذا كانت الطاقة الحركية مرتفعة في بداية العملية ، فإن الجزيئات التي تشارك في الاصطدام ستقدم اهتزازًا كبيرًا للغاية بحيث يتم كسر بعض الروابط الكيميائية الموجودة..
يعتبر كسر الروابط هو الخطوة الأولى في تحويل المواد المتفاعلة إلى منتجات ؛ وهذا هو ، في تشكيل هذه. من ناحية أخرى ، إذا كانت الطاقة الحركية في بداية هذه العملية صغيرة الحجم ، فستكون هناك ظاهرة "انتعاش" الجزيئات ، والتي من خلالها ستنفصل من الناحية العملية..
مؤشر
- 1 ماذا تتكون؟?
- 1.1 مجمع المنشط
- 2 كيف يتم حسابه?
- 2.1 حساب طاقة تنشيط التفاعل الكيميائي
- 3 كيف تؤثر طاقة التنشيط على سرعة التفاعل?
- 4 أمثلة لحساب طاقة التنشيط
- 5 المراجع
ماذا تتكون؟?
بدءاً من مفهوم التصادمات بين الجزيئات لبدء التفاعلات الكيميائية الموصوفة سابقًا ، يمكن القول أن هناك حدًا أدنى من الطاقة اللازمة لحدوث تصادم.
لذلك ، إذا كانت قيمة الطاقة أقل من هذا الحد الأدنى الضروري ، فلن يكون هناك أي تغيير بين الجزيئات بعد حدوث التصادم ، مما يعني أنه عندما تغيب هذه الطاقة ، تظل الأنواع المعنية سليمة فعليًا ولن تحدث أي تغيير بسبب هذه الصدمة.
وفقًا لترتيب الأفكار هذا ، يُطلق على الحد الأدنى من الطاقة اللازم لإجراء التغيير بعد التصادم بين الجزيئات ، طاقة التنشيط.
بمعنى آخر ، يجب أن يكون للجزيئات المتورطة في صدمة مقدار من إجمالي الطاقة الحركية مع حجم يساوي أو يزيد عن طاقة التنشيط بحيث يمكن أن يحدث تفاعل كيميائي.
أيضًا ، في كثير من الحالات ، تصطدم الجزيئات وتنشأ نوعًا جديدًا يسمى المركب المنشَّط ، وهو الهيكل الذي يُطلق عليه أيضًا "حالة الانتقال" لأنه موجود مؤقتًا فقط.
وهو ناتج عن الأنواع المتفاعلة بسبب الاصطدام وقبل تشكيل منتجات التفاعل.
مجمع المنشط
يشكل المجمع المنشط المذكور أعلاه نوعًا ذا ثبات منخفض جدًا ولكن بدوره يحتوي على كمية كبيرة من الطاقة الكامنة.
يوضح الرسم البياني التالي تحول المواد المتفاعلة إلى منتجات ، معبرًا عنها من حيث الطاقة ويلاحظ أن حجم طاقة المجمع المنشَّط الذي تم تشكيله أكبر بكثير من طاقة المواد المتفاعلة والمنتجات..
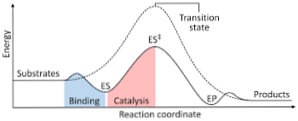
إذا كان لدى المنتجات في نهاية التفاعل استقرار أكبر من المواد المتفاعلة ، يحدث إطلاق الطاقة في صورة حرارة ، مما يعطي رد فعل طارد للحرارة..
على العكس من ذلك ، إذا كانت المواد المتفاعلة تؤدي إلى استقرار أكبر من المنتجات ، فهذا يعني أن خليط التفاعل يظهر امتصاص الطاقة في شكل حرارة من محيطها ، مما يؤدي إلى تفاعل ماص للحرارة..
وبالمثل ، في حالة حدوث حالة واحدة أو أخرى ، يجب إنشاء مخطط ، مثل الحالة الموضحة مسبقًا ، حيث يتم تخطيط الطاقة المحتملة للنظام الذي يتفاعل مع تقدم أو تقدم التفاعل..
بهذه الطريقة ، يتم الحصول على التغييرات المحتملة للطاقة التي تحدث مع استمرار التفاعل وتحول المواد المتفاعلة إلى منتجات.
كيف يتم حسابه?
ترتبط طاقة تنشيط التفاعل الكيميائي ارتباطًا وثيقًا بثبات السرعة لهذا التفاعل ، ويتم تمثيل اعتماد هذا الثابت على درجة الحرارة بواسطة معادلة أرهينيوس:
ك = Ae-EA / RT
في هذا التعبير ك يمثل ثابت معدل التفاعل (الذي يعتمد على درجة الحرارة) والمعلمة A يطلق عليه عامل التردد ، وهو مقياس لتكرار الاصطدامات بين الجزيئات.
من جانبها, و يعبر عن أساس سلسلة اللوغاريتمات الطبيعية. يتم رفعها إلى قوة مساوية للحاصل السالب لطاقة التنشيط (عصام) بين المنتج الناتج عن ثابت الغاز (R) ودرجة الحرارة المطلقة (تي) من النظام للنظر.
تجدر الإشارة إلى أن عامل التردد يمكن اعتباره ثابتًا في أنظمة رد فعل معينة على مدى درجات حرارة واسعة.
كان من المفترض أصلاً أن يكون هذا التعبير الرياضي من قبل الكيميائي من أصل هولندي Jacobus Henricus van't Hoff في عام 1884 ، لكن الذي أعطاه الصلاحية العلمية وفسر فرضيته كان الكيميائي السويدي المولد Svante Arrhenius ، في عام 1889.
حساب طاقة تنشيط التفاعل الكيميائي
تشير معادلة أرينيوس إلى التناسب المباشر الموجود بين ثابت سرعة التفاعل وتواتر الاشتباكات بين الجزيئات.
أيضا ، يمكن تمثيل هذه المعادلة بطريقة أكثر ملاءمة من خلال تطبيق خاصية اللوغاريتمات الطبيعية على كل جانب من المعادلة ، والحصول على:
ln k = ln A - Ea / RT
عند إعادة ترتيب الشروط للحصول على معادلة الخط (y = mx + b) ، يتحقق التعبير التالي:
ln k = (- Ea / R) (1 / T) + ln A
لذلك ، عند إنشاء رسم بياني لـ ln k مقابل 1 / T نحصل على خط مستقيم ، حيث يمثل ln k إحداثي y ، (- A / R) يمثل ميل الخط (m) ، (1 / T) يمثل الإحداثي x ، و ln A يمثل التقاطع مع محور الإحداثيات (ب).
كما يتضح ، فإن الميل الناتج عن هذا الحساب يساوي قيمة -Ea / R. هذا يعني أنه إذا كان المطلوب هو الحصول على قيمة طاقة التنشيط عن طريق هذا التعبير ، فيجب إجراء مسح بسيط ، مما يؤدي إلى:
EA = -MR
نحن هنا نعلم أن قيمة m و R ثابتة تساوي 8.314 J / K · mol.
كيف تؤثر طاقة التنشيط على سرعة التفاعل?
عند محاولة تكوين صورة عن طاقة التنشيط ، يمكن اعتبارها حاجزًا لا يسمح بحدوث تفاعل بين جزيئات الطاقة المنخفضة.
كما هو الحال في تفاعل شائع يحدث أن عدد الجزيئات التي يمكن أن تتفاعل كبير جداً ، يمكن أن تكون السرعة - وبشكل مكافئ ، الطاقة الحركية لهذه الجزيئات - متغيرة للغاية.
عادة ما يحدث أن كمية صغيرة فقط من إجمالي الجزيئات التي تعاني من تصادم - تلك التي لها سرعة حركة أكبر - تقدم طاقة حركية كافية لتتمكن من التغلب على حجم طاقة التنشيط. لذلك ، هذه الجزيئات ملائمة وقادرة على أن تكون جزءًا من التفاعل.
وفقًا لمعادلة أرينيوس ، تشير الإشارة السلبية - التي تسبق الحد الفاصل بين طاقة التنشيط ومنتج ثابت الغاز عند درجة الحرارة المطلقة - إلى أن ثابت السرعة يتناقص نظرًا لوجود زيادة في طاقة التنشيط ، وكذلك النمو عندما تزيد درجة الحرارة.
أمثلة لحساب طاقة التنشيط
لحساب طاقة التنشيط عن طريق إنشاء رسم بياني ، وفقًا لمعادلة آرينيوس ، لدينا أن ثوابت معدل رد فعل التحلل من الأسيتالديهيد تم قياسها في خمس درجات حرارة مختلفة ونريد تحديد طاقة التنشيط لرد الفعل ، والتي يتم التعبير عنها على النحو التالي:
CH3CHO (g) → CH4(ز) + أول أكسيد الكربون (ز)
فيما يلي بيانات القياسات الخمسة:
ك (1 / م)1/2· S): 0.011 - 0.035 - 0.105 - 0.343 - 0.789
T (K): 700 - 730 - 760 - 790 - 810
أولاً ، لحل هذا المجهول وتحديد طاقة التنشيط ، يجب أن نبني رسمًا بيانيًا لـ ln k vs 1 / T (y vs x) ، للحصول على خط مستقيم ، ومن هنا خذ الميل ونجد قيمة Ea ، كما هو موضح.
تحويل بيانات القياسات ، وفقًا لمعادلة آرينيوس [ln k = (- Ea / R) (1 / T) + ln A] ، توجد القيم التالية في y و x على التوالي:
ln k: (-4.51) - (-3.35) - (-2.254) - (-1.070) - (-0.237)
1 / T (ك-1): 1.43 * 10-3 - 1.37 * 10-3 - 1.32 * 10-3 - 1،27 * 10-3 - 1،23 * 10-3
من هذه القيم وعن طريق الحساب الرياضي للمنحدر - إما في جهاز كمبيوتر أو في آلة حاسبة ، عن طريق التعبير m = (Y2-و1) / (س2-X1) أو باستخدام طريقة الانحدار الخطي - نحصل على m = -Ea / R = -2.09 * 104 ك.
EA = (8.314 J / K · mol) (2.09 * 104 K)
= 1.74 * 105 = 1.74 * 102 kJ / mol
لتحديد طاقات التنشيط الأخرى من خلال الطريقة الرسومية ، يتم تنفيذ إجراء مماثل.
مراجع
- ويكيبيديا. (بدون تاريخ). طاقة التنشيط. تم الاسترجاع من en.wikipedia.org
- تشانغ ، ر. (2007). الكيمياء ، الطبعة التاسعة. المكسيك: ماكجرو هيل.
- Britannica، E. (s.f.). طاقة التنشيط. تم الاسترجاع من britannica.com
- Moore، J. W. and Pearson، R. G. (1961). الحركية والآلية. تم الاسترجاع من books.google.co.ve
- كايشيه ، H. (2003). تآكل المعادن: المبادئ الفيزيائية الكيميائية والمشاكل الحالية. تم الاسترجاع من books.google.co.ve


