فوسفات الكالسيوم (Ca3 (PO4) 2) هيكل وخصائص وتشكيل والاستخدامات
ال فوسفات الكالسيوم هو ملح غير عضوي وثالثي الصيغة الكيميائية الكالسيوم3(أ ف ب4)2. تنص الصيغة على أن تكوين هذا الملح هو 3: 2 للكالسيوم والفوسفات ، على التوالي. يمكن ملاحظة ذلك مباشرةً في الصورة السفلية ، حيث يتم عرض الكاتيون الكاتيوني2+ وأنيون ص43-. لكل ثلاثة كاليفورنيا2+ هناك نوعان من PO43- التفاعل معهم.
من ناحية أخرى ، يشير فوسفات الكالسيوم إلى سلسلة من الأملاح التي تختلف تبعا لنسبة الكالسيوم / ف ، وكذلك درجة الماء ودرجة الحموضة. في الواقع ، هناك العديد من أنواع فوسفات الكالسيوم الموجودة والتي يمكن تصنيعها. ومع ذلك ، في أعقاب التسمية حرفيا ، يشير فوسفات الكالسيوم فقط إلى التريكالسيوم ، المذكورة أعلاه.

جميع فوسفات الكالسيوم ، بما في ذلك الكالسيوم3(أ ف ب4)2, فهي بيضاء صلبة مع نغمات رمادية طفيفة. يمكن أن تكون حبيبية ، دقيقة ، بلورية ، ولها أحجام جسيمات حول ميكرومتر ؛ وحتى ، تم إعداد جسيمات نانوية من هذه الفوسفات ، والتي تم تصميم مواد متوافقة حيويا للعظام.
يرجع هذا التوافق الحيوي إلى حقيقة وجود هذه الأملاح في الأسنان ، وباختصار في أنسجة عظام الثدييات. على سبيل المثال ، هيدروكسيباتيت هو فوسفات الكالسيوم البلوري ، والذي يتفاعل بدوره مع مرحلة غير متبلور من نفس الملح.
هذا يعني أن فوسفات الكالسيوم غير المتبلور والبلوري موجود. لهذا السبب ، فإن التنوع والخيارات المتعددة ليست مفاجئة عند تجميع المواد القائمة على فوسفات الكالسيوم ؛ المواد التي يكون الباحثون مهتمين بها كل يوم حول العالم للتركيز على استعادة العظام.
مؤشر
- 1 هيكل فوسفات الكالسيوم
- 1.1 غير متبلور فوسفات الكالسيوم
- 1.2 باقي الأسرة
- 2 الخصائص الفيزيائية والكيميائية
- 2.1 الأسماء
- 2.2 الوزن الجزيئي
- 2.3 الوصف المادي
- 2.4 طعم
- 2.5 نقطة انصهار
- 2.6 الذوبان
- 2.7 الكثافة
- 2.8 معامل الانكسار
- 2.9 المحتوى القياسي للتدريب
- 2.10 درجة حرارة التخزين
- 2.11 درجة الحموضة
- 3 التدريب
- 3.1 نترات الكالسيوم وهيدروجين فوسفات الأمونيوم
- 3.2 هيدروكسيد الكالسيوم وحمض الفوسفوريك
- 4 الاستخدامات
- 4.1 في نسيج العظم
- 4.2 الأسمنت الحيوي الحيوي
- 4.3 الأطباء
- 4.4 أخرى
- 5 المراجع
هيكل فوسفات الكالسيوم
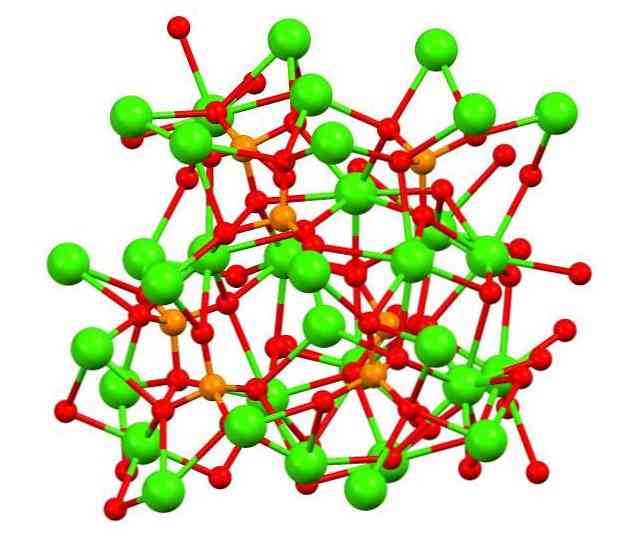
تُظهر الصورة العلوية هيكل فوسفات كاليكو التريباسيك في المعدن الأبيض الغريب ، والذي قد يحتوي على المغنيسيوم والحديد كشوائب.
على الرغم من أن النظرة الأولى قد تبدو معقدة ، فمن الضروري توضيح أن النموذج يفترض تفاعلات تساهمية بين ذرات الأكسجين في الفوسفات والمراكز المعدنية للكالسيوم.
عن طريق التمثيل يكون صحيحًا ، ومع ذلك ، فإن التفاعلات إلكتروستاتيكية ؛ وهذا هو ، الكاتيونات كاليفورنيا2+ تنجذب إلى الأنيونات PO43- (كا2+- O-PO33-). مع وضع ذلك في الاعتبار ، من المفهوم أن الكالسيوم (الكرات الخضراء) محاط في ذرات الأكسجين سالبة الشحنة (الكرات الحمراء) في الصورة.
عندما يكون هناك الكثير من الأيونات ، فإنه لا يترك أي ترتيب متماثل أو نمط مرئي. الكالسيوم3(أ ف ب4)2 يعتمد في درجات حرارة منخفضة (T<1000°C) una celda unitaria correspondiente a un sistema cristalino romboédrico; a este polimorfo se le conoce con el nombre de β-Ca3(أ ف ب4)2 (TCP-TCP ، اختصارا باللغة الإنجليزية).
في درجات الحرارة العالية ، من ناحية أخرى ، يتحول إلى متعدد الأشكال α-Ca3(أ ف ب4)2 (α-TCP) ، التي تتوافق خليتها لوحدة مع نظام بلوري أحادي. في درجات حرارة أعلى ، يمكن أيضًا تشكيل polymorph α'-Ca3(أ ف ب4)2, وهو من هيكل الكريستال سداسية.
غير متبلور فوسفات الكالسيوم
تم ذكر التركيبات البلورية لفوسفات الكالسيوم ، وهو أمر متوقع من الملح. ومع ذلك ، فهي قادرة على إظهار هياكل غير منظمة وغير متماثلة ، مرتبطة أكثر بنوع من "زجاج فوسفات الكالسيوم" أكثر من البلورات بالمعنى الدقيق لتعريفها..
عندما يحدث هذا ، يقال أن فوسفات الكالسيوم له هيكل غير متبلور (ACP), غير متبلور فوسفات الكالسيوم). يشير العديد من المؤلفين إلى أن هذا النوع من التركيب مسؤول عن الخواص البيولوجية لـ Ca3(أ ف ب4)2 في أنسجة العظام ، يمكن إصلاحه وتقليده الحيوي.
من خلال توضيح تركيبها بواسطة الرنين المغناطيسي النووي (NMR) ، تم العثور على وجود أيونات OH- و HPO42- في ACP. تتشكل هذه الأيونات بواسطة التحلل المائي لأحد الفوسفات:
PO43- + H2O <=> HPO42- + OH-
نتيجة لذلك ، يصبح الهيكل الحقيقي لـ ACP أكثر تعقيدًا ، حيث يتم تمثيل تركيبة أيوناته بالصيغة: Ca9(أ ف ب4)6-س(هبو4)س(OH)س. تشير "x" إلى درجة الماء ، لأنه إذا كانت x = 1 ، فستكون الصيغة كما يلي: Ca9(أ ف ب4)5(هبو4) (OH).
الهياكل المختلفة التي قد يكون PCA تعتمد على نسب المولي Ca / P ؛ وهذا هو ، من الكميات النسبية للكالسيوم والفوسفات ، والتي تغير كل تكوينها الناتج.
بقية العائلة
فوسفات الكالسيوم هي في الواقع عائلة من المركبات غير العضوية ، والتي بدورها يمكن أن تتفاعل مع مصفوفة عضوية.
يتم الحصول على الفوسفات الآخر "ببساطة" عن طريق تغيير الأنيونات التي تصاحب الكالسيوم (ص43-, HPO42-, H2PO4-, OH-) ، وكذلك نوع الشوائب في الصلبة. وبالتالي ، يمكن أن تنشأ ما يصل إلى أحد عشر فوسفات الكالسيوم أو أكثر ، ولكل منها هيكلها وخصائصها ، بشكل طبيعي أو صناعي..
فيما يلي بعض الفوسفات وتراكيبه والمعادلات الكيميائية:
-الهيدروجين فوسفات الكالسيوم ثنائي الهيدرات ، CaHPO4H 2H2يا: أحادي.
-هيدروجين فوسفات الكالسيوم مونوهيدرات ، كاليفورنيا (H)2PO4)2∙ ح2يا: triclinic.
-فوسفات ثاني أكسيد اللامائية ، كاليفورنيا (H)2PO4)2: triclinic.
-فوسفات أوكالسيوم الهيدروجين (OCP) ، كاليفورنيا8H2(أ ف ب4)6: triclinic وهي مقدمة في تركيب هيدروكسيباتيت.
-هيدروكسيباتيت ، كاليفورنيا5(أ ف ب4)3أوه: سداسية.
الخصائص الفيزيائية والكيميائية
أسماء
-فوسفات الكالسيوم
-فوسفات التريكالسيوم
-ثلاثي الكالسيوم ثنائي فسفات
الوزن الجزيئي
310.74 جم / مول.
الوصف المادي
إنها صلبة بيضاء عديمة الرائحة.
نكهة
لا طعم له.
نقطة انصهار
1670 ºK (1391 درجة مئوية).
الذوبانية
-غير قابلة للذوبان عمليا في الماء.
-غير قابلة للذوبان في الإيثانول.
-قابل للذوبان في حمض الهيدروكلوريك المخفف وحمض النيتريك.
كثافة
3.14 جم / سم3.
معامل الانكسار
1629
المحتوى القياسي للتدريب
4126 سعرة حرارية / مول.
درجة حرارة التخزين
2-8 درجة مئوية.
الرقم الهيدروجيني
6-8 في معلق مائي قدره 50 جم / لتر من فوسفات الكالسيوم.
تدريب
نترات الكالسيوم وهيدروجين فوسفات الأمونيوم
هناك العديد من الطرق لإنتاج أو تشكيل فوسفات الكالسيوم. واحد منهم يتكون من مزيج من أملاحين ، Ca (NO)3)2H 4H2يا ، و (NH4)2HPO4, يذوب سابقا في الكحول والماء المطلق ، على التوالي. ملح واحد يوفر الكالسيوم والفوسفات الآخر.
من هذا الخليط يترسب ACP ، والذي يخضع بعد ذلك للتدفئة في فرن عند 800 درجة مئوية ولمدة ساعتين. نتيجة لهذا الإجراء ، يتم الحصول على β-Ca3(أ ف ب4)2. من خلال التحكم بدقة في درجات الحرارة والإثارة وأوقات الاتصال ، يمكن أن يحدث تكوين البلانو.
لتشكيل polymorph α-Ca3(أ ف ب4)2 من الضروري تسخين الفوسفات فوق 1000 درجة مئوية. يتم إجراء هذا التسخين في وجود أيونات معدنية أخرى ، والتي تعمل على تثبيت هذا التعدد بشكل كافٍ ليتم استخدامه في درجة حرارة الغرفة ؛ وهذا هو ، فإنه لا يزال في حالة ميتا مستقرة.
هيدروكسيد الكالسيوم وحمض الفوسفوريك
يمكن أيضًا تشكيل فوسفات الكالسيوم عن طريق مزج محاليل هيدروكسيد الكالسيوم وحمض الفوسفوريك ، مع حدوث تحييد في قاعدة الحمض. بعد نصف يوم من النضج في الخمور الأم ، ومن الترشيح المناسب والغسيل والتجفيف والغربلة ، يتم الحصول على مسحوق حبيبي من الفوسفات غير المتبلور ، ACP.
يتفاعل منتج ACP هذا مع درجات حرارة عالية ، ويتحول وفقًا للمعادلات الكيميائية التالية:
2ca9(هبو4) (ص4)5(OH) => 2Ca9(P2O7)0.5(أ ف ب4)5(OH) + H2O (عند T = 446.60 درجة مئوية)
2ca9(P2O7)0.5(أ ف ب4)5(OH) => 3Ca3(أ ف ب4)2 + 0.5H2O (عند T = 748.56 درجة مئوية)
بهذه الطريقة ، يتم الحصول على β-Ca3(أ ف ب4)2, الأكثر شيوعا ومستقرة polymorph.
تطبيقات
في نسيج العظم
الكالسيوم3(أ ف ب4)2 هذا هو المكون الرئيسي غير العضوي من رماد العظام. إنه مكون من عمليات زرع العظام البديلة ، وهذا ما يفسره التشابه الكيميائي للمعادن الموجودة في العظام.
تُستخدم مواد حيوية من فوسفات الكالسيوم لتصحيح عيوب العظام وفي طلاء الأطراف الاصطناعية المصنوعة من التيتانيوم. ترسب فوسفات الكالسيوم عليها ، وعزلها عن البيئة وإبطاء عملية تآكل التيتانيوم.
فوسفات الكالسيوم ، بما في ذلك الكالسيوم3(أ ف ب4)2, يتم استخدامها لإنتاج مواد السيراميك. هذه المواد متوافقة حيويا ، وتستخدم حاليا لاستعادة فقدان العظم السنخي ، الناتجة عن أمراض اللثة والتهابات اللبية وغيرها من الحالات..
ومع ذلك ، يجب أن تستخدم فقط لتسريع إصلاح العظام حول الشريان ، في المناطق التي لا يوجد فيها عدوى بكتيرية مزمنة.
يمكن استخدام فوسفات الكالسيوم في إصلاح عيوب العظام ، عندما لا يكون من الممكن استخدام تطعيم عظم ذاتي المنشأ. من الممكن استخدامه بمفرده أو بالاشتراك مع بوليمر قابل للتحلل وقابل للامتصاص ، مثل حمض بولي غليكوليك.
أسمنت حيوي
اسمنت فوسفات الكالسيوم (CPC) هو مادة حيوية حيوية أخرى تستخدم في إصلاح أنسجة العظام. يتم تصنيعه عن طريق خلط مسحوق أنواع مختلفة من فوسفات الكالسيوم مع الماء ، وتشكيل عجينة. يمكن حقن العجينة أو تعديلها حسب خلل العظم أو التجويف.
يتم تشكيل الأسمنت وإعادة امتصاصه تدريجياً واستبداله بالعظام المشكلة حديثًا.
طبي
-الكالسيوم3(أ ف ب4)2 إنه ملح أساسي ، لذا فهو يستخدم كمضاد للحموضة لتحييد حمض المعدة الزائد وزيادة درجة الحموضة. في معجون الأسنان ، فإنه يوفر مصدراً للكالسيوم والفوسفات لتسهيل عملية إعادة التمعدن للأسنان وإرقاء العظام.
-كما أنه يستخدم كمكمل غذائي ، على الرغم من أن أرخص طريقة لاستبدال الكالسيوم هي من خلال استخدام كربوناته وسيتراته..
-يمكن استخدام فوسفات الكالسيوم في علاج الكزاز ونقص كلس الدم الكامن وعلاج الصيانة. بالإضافة إلى ذلك ، فإنه مفيد في مكملات الكالسيوم أثناء الحمل والرضاعة.
-يتم استخدامه في علاج التلوث باستخدام راديو النظائر المشعة (Ra-226) والسترونتيوم (Sr-90). يمنع فوسفات الكالسيوم امتصاص النظائر المشعة في الجهاز الهضمي ، مما يحد من الأضرار التي تسببها.
آخرون
-يستخدم فوسفات الكالسيوم كعلف للطيور. بالإضافة إلى ذلك ، يتم استخدامه في معاجين الأسنان للسيطرة على الجير.
-يتم استخدامه كعامل مضاد للتكتل ، على سبيل المثال لمنع ضغط ملح الطعام.
-يعمل كعامل تبيض للدقيق. بينما ، في شحم الخنزير يمنع تلوين غير مرغوب فيه ويحسن حالة القلي.
مراجع
- تونغ ام اس (1998) فوسفات الكالسيوم: التركيب والتركيب والذوبان والاستقرار. In: Amjad Z. (eds) فوسفات الكالسيوم في النظم البيولوجية والصناعية. سبرينغر ، بوسطن ، ماساتشوستس.
- Langlang Liu و Yanzeng Wu و Chao Xu و Suchun Yu و Xiaopei Wu و Honglian Dai. (2018). "التوليف ، توصيف فوسفات النانو- تريكالسيوم والتثبيط على خلايا سرطان الكبد ،" مجلة المواد النانوية ، المجلد 2018 ، معرف المقالة 7083416 ، 7 صفحات ، 2018.
- أمشاط ، المسيح وري ، مسيحي. (2010). غير متبلور فوسفات الكالسيوم: التوليف والخصائص والاستخدامات في المواد الحيوية. اكتا Biomaterialia ، المجلد. 6 (رقم 9). ص. 3362-3378. ISSN 1742-7061
- ويكيبيديا. (2019). فوسفات التريكالسيوم. تم الاسترجاع من: en.wikipedia.org
- عبيدة وآخرون. (2017). مسحوق فوسفات التريكالسيوم: قدرات التحضير والتوصيف والضغط. المجلة المتوسطية للكيمياء 2017 ، 6 (3) ، 71-76.
- بوب كيم. (2019). فوسفات الكالسيوم. تم الاسترجاع من: pubchem.ncbi.nlm.nih.gov
- إلسفير. (2019). فوسفات الكالسيوم. العلم المباشر. تم الاسترجاع من: sciencedirect.com


