ما هو الحل المشبع؟ (مع أمثلة)
ل حل المشبعة هو محلول كيميائي يحتوي على أقصى تركيز للمذاب المذاب في مذيب. يُعتبر حالة من التوازن الديناميكي حيث تكون السرعة التي يذيب فيها المذيب الذائب ومعدل إعادة التبلور متساوية (J. ، 2014).
لن يذوب المذاب الإضافي في محلول مشبع وسيظهر في مرحلة مختلفة ، سواء كان ترسبًا إذا كان صلبًا في سائل أو فاعل إذا كان غازًا في سائل (Anne Marie Helmenstine ، 2016).
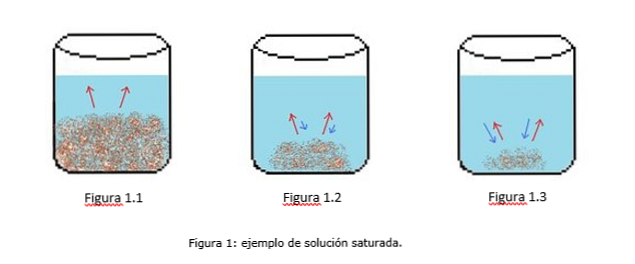
مثال للحل المشبع موضح في الشكل 1. في الشكل 1.1 و 1.2 و 1.3 ، هناك حجم ثابت من الماء في الدورق. في الشكل 1.1 ، تبدأ عملية التشبع ، حيث يبدأ المذاب في الذوبان ، ممثلة بالسهام الحمراء.
في الشكل 1.2 ، تم إذابة جزء كبير من المادة الصلبة ، ولكن ليس بسبب عملية إعادة التبلور ، والتي تمثلت في الأسهم الزرقاء.
في الشكل 1.3 ، تبقى كمية صغيرة من المذاب دون حل. في هذه الحالة ، يكون معدل التبلور أكبر من معدل الذوبان. (أنابيب التشبع ، 2014)
تُعرف نقطة التركيز الأقصى للمذاب في المذيب بنقطة التشبع.
مؤشر
- 1 العوامل التي تؤثر على التشبع
- 1.1 درجة الحرارة
- 1.2 الضغط
- 1.3 التركيب الكيميائي
- 1.4 العوامل الميكانيكية
- 2 منحنيات التشبع والذوبان
- 3 أمثلة للحلول المشبعة
- 4 ما هو الحل المشبع?
- 5 المراجع
العوامل المؤثرة في التشبع
تعتمد كمية المادة المذابة التي يمكن إذابتها في مذيب على عوامل مختلفة ، أهمها:
درجة الحرارة
الذوبان يزيد مع درجة الحرارة. على سبيل المثال ، يمكنك إذابة الملح في الماء الساخن أكثر من الماء البارد.
ومع ذلك ، قد تكون هناك استثناءات ، على سبيل المثال ، تتناقص قابلية ذوبان الغازات في الماء مع زيادة درجة الحرارة. في هذه الحالة ، تتلقى الجزيئات المذابة الطاقة الحركية عند تسخينها ، مما يسهل هروبها.
الضغط
زيادة الضغط يمكن أن يفرض انحلال المذاب. يستخدم هذا عادة لحل الغازات في السوائل.
التركيب الكيميائي
تؤثر طبيعة الذوبان والمذيب ووجود مركبات كيميائية أخرى في المحلول على الذوبان. على سبيل المثال ، يمكنك إذابة كمية أكبر من السكر في الماء ، من الملح في الماء. في هذه الحالة يقال أن السكر أكثر قابلية للذوبان.
الايثانول في الماء قابل للذوبان تماما مع بعضها البعض. في هذه الحالة بالذات ، يكون المذيب هو المركب بكمية أكبر.
العوامل الميكانيكية
على عكس معدل الذوبان ، الذي يعتمد بشكل أساسي على درجة الحرارة ، يعتمد معدل إعادة التبلور على تركيز المادة المذابة على سطح الشبكة البلورية ، والتي يتم تفضيلها عندما يكون المحلول غير متحرك.
لذلك, التحريض من الحل تجنب هذا التراكم ، وزيادة الذوبان (أنابيب التشبع ، 2014).
منحنيات التشبع والذوبان
منحنيات القابلية للذوبان هي قاعدة بيانات رسومية حيث تتم مقارنة كمية المذاب التي تذوب في كمية من المذيب ، عند درجة حرارة معينة.
عادة ما يتم رسم منحنيات الذوبان لكمية من المذاب ، إما صلب أو غاز ، في 100 غرام من الماء (براين ، 2014).
يوضح الشكل 2 منحنيات التشبع للعديد من المذاب في الماء.

في محور الإحداثيات لديك درجة الحرارة في درجة مئوية ، وفي محور الأبجدية لديك تركيز المذاب يعبر عن غراما من المذاب لكل 100 غرام من الماء.
يشير المنحنى إلى نقطة التشبع عند درجة حرارة معينة. تشير المنطقة أسفل المنحنى إلى أن لديك محلول غير مشبع وبالتالي يمكنك إضافة المزيد من الذوبان.
المنطقة فوق المنحنى بها محلول مفرط التشبع. (منحنيات الذوبان ، s.f.)
على سبيل المثال ، كلوريد الصوديوم (NaCl) ، عند درجة حرارة 25 مئوية ، يمكنك إذابة حوالي 35 جرام من كلوريد الصوديوم في 100 غرام من الماء للحصول على محلول مشبع. (جامعة كامبري ، ف.)
أمثلة على الحلول المشبعة
يمكن العثور على المحاليل المشبعة على أساس يومي ، وليس من الضروري أن تكون في المختبر الكيميائي. المذيب ليس بالضرورة أن يكون ماء. فيما يلي أمثلة يومية للحلول المشبعة:
-الصودا والمشروبات الغازية بشكل عام عبارة عن محاليل مشبعة بثاني أكسيد الكربون في الماء. لهذا السبب ، عندما يتم إطلاق الضغط ، تتشكل فقاعات ثاني أكسيد الكربون.
-التربة المشبعة مشبعة بالنيتروجين.
-يمكنك إضافة السكر أو الملح إلى الخل لتشكيل محلول مشبع.
-أضف مسحوق الشوكولاتة إلى الحليب حتى لا يذوب ، وشكل محلول مشبع.
-يمكن تشبع الحليب بالدقيق إلى الحد الذي لا يمكن إضافة المزيد من الدقيق فيه.
-يمكن تشبع الزبدة المذابة بالملح ، عندما لا يذوب الملح.
ما هو الحل المشبع?
تعريف المحلول الزائد هو محلول يحتوي على مذيب أكثر من الذوبان في المذيب. وعادة ما يتم ذلك عن طريق زيادة درجة حرارة الحل.
أي تغيير طفيف في المحلول أو إدخال "بذرة" أو بلورة صغيرة من المذاب سوف يفرض بلورة المذاب الزائد. إذا لم يكن هناك أي نقطة لتكوين البلورة ، يمكن أن تظل المادة الذائبة الزائدة في المحلول.
يمكن أن يحدث شكل آخر من فرط التشبع عندما يتم تبريد المحلول المشبع بعناية. هذا التغيير في الظروف يعني أن التركيز أكبر بالفعل من نقطة التشبع ، وقد تم تشبع الحل.
يمكن استخدام هذا في عملية إعادة التبلور لتنقية مادة كيميائية: يذوب إلى درجة التشبع في المذيب الساخن ، ثم عندما يبرد المذيب وينخفض الذوبان ، يترسب المذاب الزائد.
الشوائب الموجودة بتركيز أقل بكثير ، لا تشبع المذيب وبالتالي تظل مذابة في السائل.
مراجع
- آن ماري هيلمنستين ، ص. (2016 ، 7 يوليو). تعريف الحل المشبع والأمثلة. تم الاسترجاع من حوالي: about.com
- جامعة كامبري. (بدون تاريخ). منحنيات الذوبان. تم الاسترجاع من dynamicscience.com: dynamicscience.com.au.
- أمثلة من الحل المشبع. (بدون تاريخ). تم الاسترجاع من yourdcitionary: example.yourdictionary.com.
- , س. (2014 ، 4 يونيو). حلول مشبعة ومشبعة. تم الاسترجاع من socratic.org: socratic.org.
- جيمس ، ن.. الحل المشبع: التعريف والأمثلة. تم الاسترجاع من study.com: study.com.
- , ب. (2014 ، 14 أكتوبر). حلول مشبعة ومشبعة. تم الاسترجاع من socratic.org: socratic.org.
- منحنيات الذوبان. (بدون تاريخ). تم الاسترجاع من KentChemistry: kentchemistry.com.
- أنابيب التشبع. (2014 ، 26 يونيو). تم الاسترجاع من الكيمياء libretex: chem.libretexts.org.


