تفاعل التصبن والمواد التي يمكن الحصول عليها
ال التصبين إنه التحلل المائي الأساسي لإستر. هذا يعني أن الإستر يتفاعل مع قاعدة (NaOH أو KOH) بشكل لا رجعة فيه ، ينتج الكحول والكربوكسيل من الصوديوم أو البوتاسيوم. الكلمة تعني "صناعة الصابون" ، وفي الواقع ، هي واحدة من أقدم التفاعلات الكيميائية التي تستخدمها البشرية.
في العصر البابلي ، وبمساعدة الرماد الذي تم جمعه من الخشب والنباتات والدهون الحيوانية ، أتقنوا فن صناعة الصابون. لماذا الدهون الحيوانية؟ والسبب في ذلك أنه غني بمصنِّعي الجليسرين (الدهون الثلاثية) ، وأن رماد الخشب مصدر للبوتاسيوم ، وهو المعدن الأساسي.
خلاف ذلك ، يبدأ رد الفعل في إنتاجية أقل ، لكن يكفي لتعكس آثاره على الدهانات وبعض الأسطح. هذا هو حال اللوحات الزيتية ، حيث يتم خلط الأصباغ بالزيت (مصدر استرات).
مؤشر
- 1 رد الفعل التصبن
- 1.1 الآلية
- 1.2 حركية
- 2 المواد التي يمكن الحصول عليها عن طريق التصبن
- 2.1 عمل المذيبات من الصابون
- 3 المراجع
تفاعل التصبن
تقنية
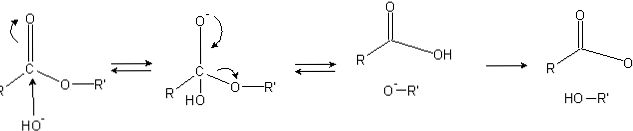
تحتوي الأسترات على مجموعة أسيل (O = C-R) ، والتي تكون عرضة للهجمات النووية مثل OH-.
نظرًا لأن ذرات الأكسجين "تسرق" الكثافة الإلكترونية من ذرة الكربون ، فهي مشحونة جزئيًا ، وحتى أكثر من ذلك في حالة استرات.
وبالتالي ، فإن هذه الشحنة الإيجابية تجذب الأنواع السالبة القادرة على تزويد الإلكترونات لذرة الكربون ، مع حدوث الهجمة النووية (الجانب الأيسر من الصورة). نتيجة لذلك ، يتم تشكيل وسيط رباعي السطوح (الجزيء الثاني من اليسار إلى اليمين).
الشحنة سالبة على الأكسجين من رباعي السطوح وسيطة هو نتاج OH- المحيطة بها. بعد ذلك ، يتم إلغاء تحديد هذه الشحنة السالبة لتكوين مجموعة الكاربونيل ، "إجبار" ثم كسر رابط C-OR. أيضا ، هذا النقل ينتج حمض الكربوكسيل RCOOH وألكوكسيد أيون R'O-.
أخيرًا ، نظرًا لأن وسط التفاعل أساسي ، يقوم ألكوكسيد بنقل جزيء واحد من الماء ويتفاعل حمض الكربوكسيل مع OH آخر- من الوسط ، وتوليد منتجات التصبن.
حركية
تتناسب سرعة تفاعل التصبن مع تركيزات المواد المتفاعلة. بمعنى آخر ، بزيادة تركيز الإستر (RCOOR) أو القاعدة (NaOH) ، سوف يستمر التفاعل بمعدل أعلى.
يُترجم هذا أيضًا على النحو التالي: معدل التصويب هو الترتيب الأول فيما يتعلق بالإستر ، والأمر الأول فيما يتعلق بالقاعدة. يمكن التعبير عن ما سبق بالمعادلة الرياضية التالية:
السرعة = ك [RCOOR '] [هيدروكسيد الصوديوم]
حيث k هو معامل ثابت أو السرعة ، والذي يختلف كدالة في درجة الحرارة أو الضغط ؛ أي أنه كلما ارتفعت الحرارة ، زادت سرعة التصبن. لهذا السبب يخضع الوسط للغليان.
نظرًا لأن كلا الكاشفين من النوع الحركي الأول ، يكون رد الفعل الكلي هو الترتيب الثاني.
في آلية تفاعل التصبغ ، يتطلب تشكيل رباعي السطوح الوسيط هجومًا نوويًا يشتمل على الإستر والقاعدة..
وبالتالي ، تنعكس حركية الدرجة الثانية في هذه الحقيقة ، لأنها تتدخل في الخطوة المحددة (البطيئة) للتفاعل.
المواد التي يمكن الحصول عليها عن طريق التصبن

المنتجات الرئيسية للتصبن هي الكحول وأملاح الأحماض الكربوكسيلية. في وسط الحمض ، يتم الحصول على RCOOH المعني ، والذي يتم الحصول عليه عن طريق تصبن الدهون والزيوت ، والتي تعرف باسم الأحماض الدهنية..
بهذه الطريقة ، تتكون الصابون من أملاح الأحماض الدهنية الناتجة عن التصبن. هل الخروج مع ما الكاتيونات؟ يمكن أن يكون نا+, K+, ملغ2+, إيمان3+, الخ.
هذه الأملاح قابلة للذوبان في الماء ، ولكن تترسب نتيجة عمل كلوريد الصوديوم المضافة إلى الخليط ، الذي يجفف الصابون ويفصله عن المرحلة المائية. تفاعل التصبن لثلاثي الغليسريد هو كما يلي:
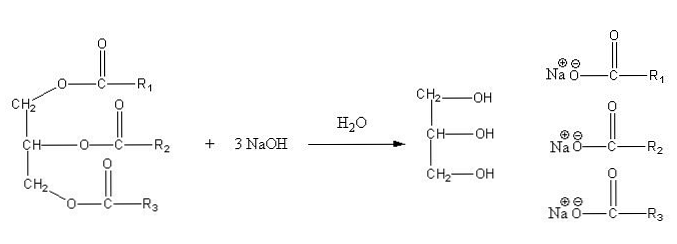
الجليسرين هو الكحول "E" ، والصابون هو كل أملاح الأحماض الدهنية الناتجة. هنا ، كل جانب - R له أطوال مختلفة ودرجة عدم التشبع. وبالتالي ، فإن هذه السلاسل تحدث فرقًا بين الدهون والزيوت النباتية.
يكمن مفتاح صناعة الصابون في اختيار أفضل أنواع الدهون والزيوت ، أو بشكل أكثر تحديدًا ، في اختيار مصادر مختلفة من الدهون الثلاثية.
يمكن أن تحتوي كتلة الصابون الأبيض على أصباغ ومركبات عضوية أخرى في بنيتها ، مما يمنحها رائحة عطرية وألوان زاهية. من هنا ، يتم ترويض مجموعة من الاحتمالات عن طريق الفن والمهن في هذه التجارة.
ومع ذلك ، فإن تفاعل التصبغ هو أيضًا طريق اصطناعي للأحماض والكربوكسيل والكحوليات التي لا ترتبط بالضرورة بالجلسرين أو الصابون.
على سبيل المثال ، يؤدي التحلل المائي الأساسي لأي استر ، مثل خلات الإيثيل البسيطة ، إلى إنتاج حمض الأسيتيك والإيثانول.
المذيبات العمل من الصابون

أملاح الأحماض الدهنية قابلة للذوبان في الماء ، ولكن ليس بنفس طريقة إذابة الأيونات ؛ وهذا هو ، وتحيط بها كرة مائية. في حالة الصابون ، تمنع سلاسلها الجانبية -R من الناحية النظرية من الذوبان في الماء.
لذلك ، لمواجهة هذا الموقف غير المريح بشدة ، فهي موجهة بطريقة تتلامس فيها هذه السلاسل ، وتشكل نواة عضوية قطبية ، بينما الرؤوس القطبية ، النهاية (-COO)- نا+) ، التفاعل مع جزيئات الماء وإنشاء "قذيفة قطبية".
ما سبق موضح في الصورة أعلاه ، حيث يظهر هذا النوع من الهيكل المعروف باسم micelle.
تتوافق "ذيول سوداء" مع سلاسل مسعور ، وتصبح متشابكة في جوهر العضوية المحمية من المجالات الرمادية. تشكل هذه الكرات الرمادية الدرع القطبي ، الرؤوس -COO- نا+.
ثم ، micelles هي مجموعات (مجموعات) من أملاح الأحماض الدهنية. في داخلها ، يمكنهم إحاطة الدهون غير القابلة للذوبان في الماء بسبب طابعها المفترس.
كيف يفعلون ذلك؟ كل من سلاسل الدهون و- R غير مسعور ، لذلك كلاهما تقارب كبير لبعضهما البعض.
عندما تطوق micelles الدهون ، يتفاعل الماء مع القشرة القطبية ، مما يسمح للذوبان في الصابون. وبالمثل ، فإن micelles مشحونة سالبًا ، مما يتسبب في تنافر بعضها البعض ، وبالتالي توليد تشتت الدهون.
مراجع
- آن ماري هيلمنستين ، دكتوراه (3 أكتوبر 2017). تعريف التصبن ورد الفعل. تم الاسترجاع في 24 أبريل ، 2018 ، من: thinkco.com
- فرانسيس كاري. الكيمياء العضوية الأحماض الكربوكسيلية. (الطبعة السادسة ، ص 863-866). مولودية جراو هيل.
- غراهام سولومونز تي. دبليو ، كريج بي فرايل. الكيمياء العضوية. الدهون (الطبعة 10. ، صفحة 1056-1058). وايلي بلس.
- ويكيبيديا. (2018). التصبين. تم الاسترجاع في 24 أبريل 2018 من: en.wikipedia.org
- بويد سي (27 فبراير 2015). فهم كيمياء وتاريخ الصابون. تم الاسترجاع في 24 أبريل ، 2018 ، من: chemservice.com
- لوكا لاغي (27 مارس 2007). التصبين. تم الاسترجاع في 24 أبريل 2018 ، من: commons.wikimedia.org
- أماندا كروشيه (12 مايو 2015). Micelle (تدرج الرمادي). تم الاسترجاع في 24 أبريل 2018 ، من: commons.wikimedia.org


