خصائص المذاب ، الاختلافات مع المذاب والمذيبات ، أمثلة
ال المذاب, في حل,هو المادة التي تذوب في المذيب. عمومًا ، يوجد المذاب بنسبة أقل ، ويمكن أن يكون صلبًا أو سائلاً أو غازيًا. على العكس من ذلك ، المذيب هو مكون الحل في كمية أكبر.
على سبيل المثال ، في الماء المالح ، يكون الملح هو المذاب والماء هو المذيب. ومع ذلك ، ليست كل المواد الصلبة صلبة أو المذيبات سائلة.

في هذا المعنى ، هناك عدة مجموعات محتملة من المذيبات والمذيبات: غاز في سائل ، غاز في صلب ، سائل في سائل ، سائل صلب ، صلب في سائل أو صلب في صلب.
لإدراك ما هو المذاب في الحل ، يجب مراعاة جانبين. أولاً ، المذاب هو المادة التي تكون أصغر. بالإضافة إلى ذلك ، هو الذي يغير حالته المادية (صلبة أو سائلة أو غازية) عند دمجها في المحلول.
مؤشر
- 1 المحاليل والمذيبات والمواد المذابة
- 2 تعريف المذاب
- 3 خصائص
- 3.1 الذوبان
- 3.2 درجة الحرارة
- 3.3 تشبع الحل
- 3.4 الضغط
- 3.5 قطبية
- 4 الاختلافات بين المذاب والمذيبات
- 5 أمثلة من المذاب
- 5.1 Solutos في الحالة الغازية
- 5.2 Solutos في الحالة الصلبة
- 5.3 Solutos في الحالة السائلة
- 5.4 Solutos التي يمكن استخدامها في المنزل
- 6 المراجع
المحاليل والمذيبات والمواد المذابة
توجد في الكيمياء مخاليط متجانسة ، وهي تلك التي لها مكوناتها مقسمة إلى نسب متساوية من خلال محتواها. أحد المحاليل الأكثر شيوعًا للمخاليط المتجانسة هي المحاليل ، وهي مخاليط متجانسة مستقرة من مادتين أو أكثر ، حيث يذوب المذاب في مذيب.
يتم ملاحظة المحاليل والمذيبات والمواد المذابة في المواقف اليومية وفي مجموعة متنوعة من صناعية إلى مخبرية. هذه المواد المكونة من الخلائط هي كائنات للدراسة بسبب الخصائص التي تقدمها والقوى و / أو عوامل الجذب التي تحدث بينهما..
تعريف المذاب
كما هو مذكور أعلاه ، المذاب هو تلك المادة التي تذوب في مادة أخرى تسمى المذيب.
عادة ما يكون للمذاب نسبة أصغر ويمكن أن يحدث في أي من الحالات الثلاث للمادة. عندما يتم إعطاء محلول بين مادتين في نفس المرحلة ، يتم استخدام طريقة اختيار ذلك في نسبة أصغر لتحديد أي المذاب وأي المذيب.
تخضع قدرة الذوبان للذوبان للذوبان. تمثل درجة حرارة المذيب أيضًا عاملًا محددًا عندما يتعلق الأمر بمعرفة إمكانية تكوين المحلول أو عدمه ، حيث أنه كلما ارتفعت درجة حرارة المذيب ، زادت كمية المذاب التي يمكن حله في هذا.
هناك مواد تسمى السطحي تصبح أقل قابلية للذوبان في درجات الحرارة العالية ، لكنها استثناءات وتؤدي أدوارًا محددة.
تُعرَّف العملية التي يتفاعل فيها المذيب مع مادة مذابة لتشكيل محلول على أنها حل ، وتشتمل على تكوين روابط وجسور هيدروجينية ، بالإضافة إلى عوامل الجذب بواسطة قوى فان دير فال..
ملامح
تشتمل المواد المذابة على مجموعة متنوعة هائلة من المواد الكيميائية في حالات مختلفة ولديها قدرات ذوبان مختلفة ولديها العديد من الخصائص التي تلعب دورًا مهمًا في تكوين مخاليط متجانسة. بعض الخصائص الرئيسية للذرات هي كما يلي:
الذوبانية
الذوبان هو قدرة المركب على الذوبان في مادة أخرى. هذه القدرة لها علاقة وثيقة مع الاختلاط ، وهي قدرة السائل على الاختلاط مع واحدة محددة ؛ إذا لم تتمكن من الانضمام ، فهذا أمر لا غنى عنه.
يحتوي الاختلاط على نطاق أكثر من رقم محدد ، لذلك يمكن القول أن إحدى المواد قابلة للاختلاط كليًا أو جزئيًا أو غير قابل للاختلاط في مادة أخرى.
تعتمد خاصية الذوبان في المادة المذابة بدورها على عوامل أخرى يمكن أن تزيد أو تنقص هذه السعة بسبب تأثيرها على توازن القوى بين الجزيئات التي تنشأ بين المذاب والمذيب.
حتى الميزات الأقل توقعًا ، مثل حجم نقطة الذوبان أو الترتيب في بنية البلورة ، يمكن أن تؤثر على قدرتها على الذوبان.
درجة الحرارة
يمكن أن تؤثر درجة حرارة النظام حيث يذوب المذاب في قابلية ذوبانه: بالنسبة لمعظم المواد الصلبة والسوائل ، تزيد هذه القدرة من ذوبانها وفقًا لزيادة درجة الحرارة.
في المقابل ، في الغازات ، يلاحظ وجود سلوك معقد يظهر كذوبانية أقل في الماء في درجات حرارة أعلى ، ولكن سلوك أكبر في المذيبات العضوية.
تشبع الحل
ويطلق عليه تشبع الحل إلى الدرجة التي حل فيها المحلول المذاب ، ويسمى الحل المشبع لما حل المذاب قدر الإمكان. من هذه النقطة ، سوف يترسب المذاب المضاف كزيادة في أسفل الحاوية المستخدمة ؛ قبل هذا ، يسمى الحل غير المشبع.
من الممكن تجاوز نقطة التشبع ومواصلة إذابة المذاب ، لكن هذا يتطلب زيادة في درجة الحرارة. ويطلق على المحلول الذي يحتوي على فائض من المذاب والذي تم تسخينه حلاً مفرط التشبع.
الضغط
لا تؤثر تغيرات الضغط عادةً على قابلية ذوبان المواد الصلبة والسوائل ، بصرف النظر عن بعض الحالات الاستثنائية (تراكم كبريتات الكالسيوم في أنابيب البترول) ، ولكن في الغازات يعد عاملاً محددًا لقدرتها على الذوبان.
في الواقع ، قابلية ذوبان الغاز في المذيب تتناسب بشكل مباشر مع الضغط الجزئي لهذا الغاز على المذيب المذكور.
قطبية
قطبية المذاب أمر بالغ الأهمية عند قياس قدرته على الذوبان ؛ سوف تذوب المادة المذابة بشكل أفضل في مذيب له تركيبة كيميائية مماثلة لتلك الموجودة به.
على سبيل المثال ، ستكون المواد شديدة القطبية أو المحبة للماء أكثر قابلية للذوبان في المذيبات شديدة القطبية ، بينما ستكون غير قابلة للذوبان عملياً في المواد غير القطبية..
وبالمثل ، تلعب القوى بين الجزيئات دورًا مهمًا في المذيبات والسهولة التي يمكن بها للمذيب أن يحل مادة مذابة: كلما زادت قوة ثنائي القطب ثنائي القطب ، وروابط الهيدروجين وغيرها من الروابط ، زادت قدرة المذيب على الذوبان المذاب وتشكيل الحل.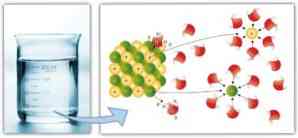
الاختلافات بين المذاب والمذيبات
- المذاب هو المادة الذائبة. المذيب هو الوسيلة لحل المذاب.
- يمكن أن يكون المذاب في مرحلة صلبة أو سائلة أو غازية ؛ يكون المذيب عادة في الطور السائل ، ولكنه موجود أيضًا في الحالة الصلبة والغازي.
- القابلية للذوبان من المذاب يعتمد أكثر على خصائص مثل السطح ؛ تعتمد قدرة المذيب على القطبية ودرجة الحرارة والضغط ، من بين عوامل أخرى.
- المذاب هو عادة العنصر المطلوب لاستخلاصه في العمليات الصناعية ؛ المذيب عادة لا يكون العنصر المطلوب ويتم تجاهله في العمليات الصناعية.
أمثلة من المذاب
- السكر مثال على ذوبان المرحلة الصلبة ، وعادة ما يستخدم لتحلية المياه.
- يمكن العثور على الهكسين في شمع البارافين ، حيث يعمل كمذيب سائل يجعل هذه المادة الصلبة أكثر مرونة.
- ثاني أكسيد الكربون هو غاز يضاف إلى المشروبات لمنحهم النعاس.
Solutos في حالة غازية
ثاني أكسيد الكربون في الماء (المشروبات الغازية)
الماء الكربوني هو الماء الذي يحتوي على ثاني أكسيد الكربون وينتج عن طريق تمرير ثاني أكسيد الكربون تحت الضغط من خلال الماء.
المياه المعدنية الغازية تحدث بشكل طبيعي لفترة طويلة. هذه المياه الفوارة موجودة بسبب زيادة ثاني أكسيد الكربون في طبقة المياه الجوفية التي تذوب تحت الضغط.
واحدة من أفضل الأمثلة المعروفة للمذاب هي المشروبات الغازية التجارية ، والتي يتم دمجها مع شراب.
وجود ثاني أكسيد الكربون يجعل هذه المياه والمشروبات الغازية أكثر فاتح للشهية وجاذبية بصرية.
الأكسجين والغازات الأخرى في النيتروجين (الهواء)
يتكون الهواء الموجود في الغلاف الجوي من جزيئات الغازات المختلفة. يتكون أساسا من 78 ٪ من النيتروجين وحوالي 21 ٪ من الأكسجين (المذاب). بالإضافة إلى ذلك ، يحتوي على حوالي 1٪ من جزيئات الأرجون وجزيئات أخرى ، ولكن بكميات صغيرة جدًا.
البروبان في البيوتان (غاز الطهي)
بدأ استخدام هذا المزيج ، المعروف أيضًا باسم غاز البترول المسال (LPG) ، منذ عام 1860 كمصدر للوقود للأغراض المنزلية..
منذ ذلك الحين وسعت إنتاجها واستهلاكها للاستخدام المنزلي والصناعي. نظرًا لأن كلا الغازين عديم الرائحة والخطر ، تتم إضافة مادة تسمى ميركابتان ، مما يجعل أي تسرب محسوسًا..
Solutos في الحالة الصلبة
الزنك النحاس (النحاس)
يتكون السبائك التجارية المعروفة بالنحاس من الزنك (من 5 إلى 40٪) المذاب في النحاس. الزنك يساعد على زيادة قوة الشد. يمكن إضافة عناصر أخرى مثل القصدير والحديد والألومنيوم والنيكل والسيليكون إلى هذه السبائك.
اليود في الكحول (صبغة اليود)
مثال آخر على المذاب المعروف شعبيا هو صبغة اليود. هذا الحل يحتوي على اليود في الكحول الإيثيلي (من 44 إلى 50 ٪). يستخدم صبغة اليود كمطهر.
الملح في الماء (ماء البحر)
تغطي مياه البحر أكثر من 70٪ من سطح الأرض. هذا هو مزيج معقد من 96.5 ٪ من المياه ، 2.5 ٪ أملاح وكميات أقل من المواد الأخرى. وهذا يشمل المواد العضوية غير العضوية والمذابة ، والجزيئات وبعض الغازات في الغلاف الجوي.
Solutos في الحالة السائلة
الكحول في الماء (المشروبات الكحولية)
يتم خلط الإيثانول أو الكحول الإيثيلي (المذاب) من تخمير السكر بالماء بنسب ثابتة لإنتاج المشروبات الكحولية..
يهضم الجسم هذا المركب بسهولة ، لكن استهلاكه الزائد يمكن أن يتسبب في أضرار جسيمة للصحة.
الماء في الهواء (الرطوبة في الهواء)
الماء في الهواء يعرف باسم الضباب. يحدث هذا بسبب قطرات صغيرة من الماء معلقة في الهواء ، ويرجع ذلك أساسًا إلى تبريد الأرض أثناء الليل.
بهذه الطريقة ، يؤدي هذا التبريد إلى انخفاض درجة حرارة الهواء المحيط به. ثم ، تحدث هذه الظاهرة عندما يحتفظ الماء المكثف في هذا.
حامض الخليك في الماء (الخل)
الخل سائل ذو نكهة حادة تستخدم لإضافة نكهة أو الحفاظ على الطعام. يتم تحضيره بواسطة محلول حمض الخليك الممزوج بالماء.
تركيز حمض الخليك متغير. على سبيل المثال ، يحتوي الخل المقطر على نسبة تتراوح من 5 إلى 8٪.
الزئبق بالفضة (الملغم أو حشوات الأسنان)
تتشكل الملغم المستخدم في حشوات الأسنان بنسبة 2٪ من الزئبق باستخدام سبيكة تعمل كمذيب. هذه السبائك تحتوي على 70٪ فضة. يمكنك أيضا إضافة القصدير والنحاس والزنك.
Solutos التي يمكن استخدامها في المنزل
السكر في الماء
السكر مركب جزيئي وقطبي ، وبالتالي لديه القدرة على الذوبان في الماء ، وهو أيضًا عنصر قطبي.
الطريقة التي يتم بها تنظيم السكر ستؤدي إلى اختلاف عملية الذوبان. على سبيل المثال ، إذا كان السكر في كتل ، فسوف يستغرق الذوبان وقتًا أكبر من الوقت إذا كان في الحبوب.
يعتقد بعض الخبراء أن الماء مع السكر هو مصدر مهم للغاية للطاقة للجسم. حتى أن هناك دراسات تكشف عن فعالية هذا الحل في الأشخاص الذين يمارسون النشاط البدني.
السكر في الدقيق
من الشائع لإعداد كعكة أن تخلط المكونات الصلبة أولاً ، ثم تضاف السوائل.
السكر هو مادة مذابة متصلة بالدقيق ، مما يؤدي إلى خليط أساسي من الكعكة. بالإضافة إلى هذين المكونين ، تتم إضافة مكونات أخرى لاحقًا ، مثل البيض أو الزبدة أو الفانيليا.
هذا النوع من المذاب صلب ، وفي هذه الحالة يتم مزجه بمذيب صلب أيضًا. يمكن أيضًا استخدام القاعدة الناتجة لصنع الخبز الحلو والكعك والكعك وكعك الإسفنج والحلويات الصغيرة والعديد من الأطعمة الحلوة الأخرى.
مسحوق عصير في الماء
هناك مجموعة واسعة من العصائر المسحوقة التي يتم تحضيرها عن طريق إذابة هذا العنصر في الماء. في هذه الحالة يكون المذاب هو مسحوق العصير والمذيب هو الماء.
يجب أن تكون كمية المذيب أكبر من المذيب ، لذلك عادةً تُذوب ملعقة أو ملعقتان كبيرتان من مسحوق العصير في كوب من الماء. حتى أن هناك بعض المساحيق التي يكون تركيزها أعلى ويجب استخدام كمية أصغر.
هناك منتقدون لهذه العصائر ، لأنها تشير إلى أن المكونات التي تشملها (مثل المواد الحافظة والمثبتات والمحليات ، وغيرها) ضارة بالصحة.
الكلور في الماء
طريقة واحدة لتنقية المياه هي استخدام الكلور كمذاب مذاب في الماء. يتميز هذا المطهر بكونه واحدًا من أكثر الأدوات المستخدمة للقضاء على الميكروبات ، وهو مثالي لتحويل المياه غير الصالحة للشرب إلى مياه الشرب بطريقة سريعة واقتصادية وسهلة.
يجب دمج الكلور كمذاب في هذا المحلول في الماء بتركيز لا يزيد عن 0.2 و 0.5 ملليغرام لكل لتر.
يجب أن تكون كمية الكلور المراد استخدامها منخفضة للغاية ، لأن هذه المادة يمكن أن تكون شديدة السمية عند استهلاكها أو التعرض لها بكميات كثيرة.
تُعرف هذه الطريقة لتنقية المياه بالكلورة ، ويمكن تطبيقها في منتصف رحلة إلى الجبل أو لمعالجة المياه في المنزل ، من أجل القضاء على البكتيريا والميكروبات التي قد توجد في الأنابيب التي تمر بها المياه..
الطلاء في الماء
الماء هو المذيب الأكثر شيوعًا الموجود ، وهو أيضًا الأساس الذي يمكن أن تذوب فيه مادة مذيبة مثل الطلاء.
يذوب الطلاء عادةً لأسباب مختلفة. الأكثر شيوعًا هو تسهيل تنظيف الفرش والأدوات الأخرى المستخدمة في الطلاء.
هناك العديد من أنواع اللوحات. تلك التي تذوب أفضل في الماء هي تلك اللاتكس. بالإضافة إلى السماح بتنظيف أفضل للأدوات ، تتمثل ميزة تخفيف الطلاء في الماء قبل البدء في الطلاء في أنه سيضمن إنهاء أفضل على السطح المطلي.
مسحوق الحليب في الماء
مسحوق الحليب هو مادة مذابة تتشكل من خلال جفاف اللبن الذي تم بالفعل تبخيره. الغرض من هذه العملية هو ضمان إمكانية تخزين الحليب بشكل أفضل لفترة أطول.
يذوب هذا المذاب في الماء ويولد الحليب السائل الذي يتم تناوله عادة في وجبة الإفطار ، جنبا إلى جنب مع القهوة أو في مستحضرات مختلفة.
كما في حالة مسحوق العصير ، يجب أن تكون كمية الحليب المخفف أقل من كمية الماء التي تريد تحضير المحلول فيها.
المنظفات في الماء
عند غسل الملابس ، يتم استخدام المنظفات السائلة أو المسحوق. يتم إذابة هذه في الماء لتشكيل الحل الذي يعمل بمثابة مطهر ونظافة الأقمشة النسيجية.
تكون كمية المادة المذابة التي يجب استخدامها في هذا المحلول متغيرة ، اعتمادًا على نوع المنظف وعرضه نفسه والمكونات التي يحتوي عليها.
يمكن أن يكون المحلول المكوّن من المنظفات والماء ملوثًا جدًا عندما يتلامس مع مقالب المياه ، لذلك يُنصح باستخدام المنظفات القابلة للتحلل الحيوي ، والتي قد تتحلل في وقت قصير جدًا وتؤثر على البيئة بدرجة أقل.
الجيلاتين
الجيلاتين عنصر مكون من الأوتار والأربطة وعظام الحيوانات. يمكن أن يكون هذا المركب في مسحوق أو في صفائح.
في كلتا الحالتين ، يجب إذابة هذا المذاب في الماء الساخن لتحقيق النتيجة النهائية: مثالية الغذاء الحلو للحلوى مع العديد من الفوائد الصحية.
من بين فوائد هذا المركب أنه يفضل إصلاح الأنسجة السريع وهو غذاء مضاد للالتهابات. بالإضافة إلى ذلك ، يحتوي على كمية كبيرة من البروتينات ويلعب دورًا مهمًا في تعزيز الجهاز المناعي.
تناول كمية يومية صغيرة من الجيلاتين سيساعد في تجديد المفاصل وبالتالي توقع ظهور مرض هشاشة العظام.
الشوكولاته في الحليب
الشوكولاتة هي عنصر يتشكل بفضل مزيج من زبدة الكاكاو والكاكاو. يعمل هذا الطعام كمذاب عند خلطه مع الحليب لإعداد ما يعرف باسم الشوكولاتة الساخنة.
لهذا المستحضر يتم تسخين الكمية المطلوبة من الحليب وتضاف الشوكولاتة ، على شكل قطع أو مسحوق أو سائل ، مع التحريك باستمرار.
حتى يذوب هذا المذاب بأفضل طريقة ممكنة ويتجنب الكتل من الضروري التغلب على الخليط دون توقف.
مسحوق الكاكاو في الماء
يمكنك أيضًا تحضير الشوكولاته الساخنة باستخدام مسحوق الكاكاو. يتكون هذا المذاب فقط من كتلة الكاكاو المجفف. على عكس الشوكولاته ، لا يشمل الكاكاو زبدة هذه الفاكهة.
يمكن إذابة الكاكاو تمامًا في الماء لإنتاج مشروب بنكهة الشوكولاتة. في هذه الحالات ، من الضروري تحلية الخليط بالسكر أو العسل أو بعض المحليات ؛ وإلا فإن النتيجة ستكون مريرة للغاية.
مراجع
- لامبرت ، ن. ومحمد ، م (1993). الكيمياء ل CXC. أوكسفورد: هاينمان.
- Steen، D. P. (2008). ثاني أكسيد الكربون ، الكربنة ومبادئ تكنولوجيا التعبئة. In D. P. Steen، Philip and P. R. Ashurst (editors)، Carbonated Soft Drinks: Formulation and Manufacture، pp. 112-143. أكسفورد: دار نشر بلاكويل.
- ماذا في الهواء؟ (ق / و). مركز جامعة كاليفورنيا لتعليم العلوم. تم الاسترجاع في 17 أكتوبر 2017 ، من eo.ucar.edu
- غاز البترول المسال. (2013 ، 12 يوليو). موسوعة بريتانيكا.
تم الاسترجاع في 16 أكتوبر 2017 ، من britannica.com - Lytle، D. A. and Schock، M. R. (1996). ركود الوقت ، والتكوين ، ودرجة الحموضة ، وآثار الفوسفات على غسل المعادن من النحاس. أوهايو: الولايات المتحدة وكالة حماية البيئة.
- كرابي ، ت. Pelletier، S. J. and Pruett، T. L. (2001). التعقيم الجراحي في S. S. Block (محرر) ، التطهير والتعقيم والحفظ ، ص. 919-934. فيلادلفيا: ليبينكوت ويليامز آند ويلكينز.
- Byrne، R. H. et al (2017، 07 June). مياه البحر. موسوعة بريتانيكا. تم الاسترجاع في 17 أكتوبر 2017 ، من britannica.com
- Plutowska B. and Wardencki، W. (2012). كروماتوجرافيا الغاز olfactometry من المشروبات الكحولية. في J. Piggott (محرر) ، المشروبات الكحولية: التقييم الحسي وأبحاث المستهلك ، ص. 101-122. فيلادلفيا: وودهيد للنشر.
- ما هو الضباب؟ (2017 ، 12 يوليو). مكتب الأرصاد الجوية (المملكة المتحدة). metoffice.gov.uk
- Helmenstine، A. M ... (2016، 16 February). ما هو التركيب الكيميائي للخل؟ تم الاسترجاع في 17 أكتوبر 2017 ، من thinkco.com
- Phinney، D. J. and Halstead، J. H. (2017). مساعدة الأسنان: نهج شامل. ماساتشوستس: Cengage التعلم.
- Britannica، E. (s.f.). حل الكيمياء. تم الاسترجاع من britannica.com
- ويكيبيديا. (بدون تاريخ). الذوبان. تم الاسترجاع من en.wikipedia.org
- Classzone. (بدون تاريخ). المواد المذابة. تم الاسترجاع من frsd.k12.nj.us
- ChemGuide. (بدون تاريخ). حلول المشبعة والذوبان. تم الاسترجاع من chem.libretexts.org
- Madhusha. (بدون تاريخ). الفرق بين المذيب والمذاب. تم الاسترجاع من pediaa.com.


