الحجم الذري كيف يتغير في الجدول الدوري والأمثلة
ال الحجم الذري هي قيمة نسبية تشير إلى العلاقة بين الكتلة المولية للعنصر وكثافته. لذلك ، يعتمد هذا الحجم على كثافة العنصر ، والكثافة تعتمد بدورها على الطور وعلى كيفية ترتيب الذرات داخل هذا.
لذا فإن الحجم الذري لعنصر Z ليس هو نفسه في مرحلة أخرى مختلفة عن تلك التي تظهر في درجة حرارة الغرفة (سائلة ، صلبة أو غازية) ، أو عندما تكون جزءًا من مركبات معينة. وبالتالي ، فإن الحجم الذري Z في المركب ZA يختلف عن الحجم Z في المركب ZB.

لماذا؟ لفهمها ، من الضروري مقارنة الذرات بالرخام ، على سبيل المثال. لقد حددت الرخام ، مثله مثل تلك المزرقة في الصورة الفائقة ، حدودها المادية ، والتي يتم ملاحظتها بفضل سطحها اللامع. في المقابل ، فإن حدود الذرات منتشرة ، على الرغم من أنها يمكن اعتبارها كروية عن بعد.
وبالتالي ، فإن ما يحدد نقطة ما وراء الحدود الذرية هو الاحتمال الخالي لإيجاد إلكترون ، وهذه النقطة قد تكون أبعد أو أقرب إلى النواة اعتمادًا على عدد الذرات المجاورة التي تتفاعل حول الذرة..
مؤشر
- 1 الحجم الذري ونصف القطر
- 2 صيغة إضافية
- 3 كيف يختلف الحجم الذري في الجدول الدوري?
- 3.1 الكميات الذرية للمعادن الانتقالية
- 4 أمثلة
- 4.1 مثال 1
- 4.2 مثال 2
- 5 المراجع
الحجم الذري ونصف القطر
من خلال التفاعل بين ذرتين H في جزيء H2, يتم تعريف مواقع نواتها وكذلك المسافات بينها (المسافات النووية). إذا كانت كلتا الذرتين كروية ، فإن نصف القطر هو المسافة بين النواة والحدود المنتشرة:
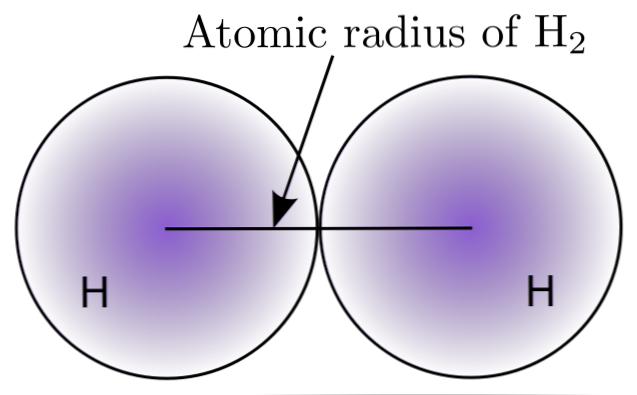
في الصورة العلوية ، يمكن ملاحظة كيف تقل احتمالية العثور على إلكترون مع ابتعاده عن النواة. بتقسيم المسافة النووية بين اثنين ، يتم الحصول على نصف القطر الذري. بعد ذلك ، بافتراض هندسة كروية للذرات ، نستخدم الصيغة لحساب حجم الكرة:
V = (4/3) (Pi) r3
في هذا التعبير ، r هو نصف القطر الذري المحدد لجزيء H2. يمكن أن تتغير قيمة V المحسوبة بهذه الطريقة غير الدقيقة إذا ، على سبيل المثال ، تم اعتبارها H2 في حالة سائلة أو معدنية. ومع ذلك ، فإن هذه الطريقة غير دقيقة للغاية لأن أشكال الذرات بعيدة عن المجال المثالي في تفاعلاتها.
لتحديد الأحجام الذرية في المواد الصلبة ، يتم أخذ العديد من المتغيرات المتعلقة بالترتيب في الاعتبار ، ويتم الحصول عليها من خلال دراسات حيود الأشعة السينية..
صيغة إضافية
تعبر الكتلة المولية عن مقدار المادة التي تحتوي على مول من ذرات عنصر كيميائي.
وحداتها هي غرام / مول. من ناحية أخرى ، تكون الكثافة هي الحجم الذي يشغل غرامًا واحدًا من العنصر: g / mL. نظرًا لأن وحدات الحجم الذري تكون mL / mol ، يجب أن تلعب مع المتغيرات للوصول إلى الوحدات المطلوبة:
(جم / مول) (مل / جم) = مل / مول
أو ما هو نفسه:
(الكتلة المولية) (1 / D) = V
(الكتلة المولية / D) = V
وبالتالي ، يمكن بسهولة حساب حجم جزيء واحد من ذرات عنصر ؛ بينما مع صيغة المجلد الكروي يتم حساب حجم الذرة الفردية. للوصول إلى هذه القيمة من الأولى ، يلزم إجراء تحويل من خلال رقم Avogadro (6.02 · 10).-23).
كيف يختلف الحجم الذري في الجدول الدوري؟?
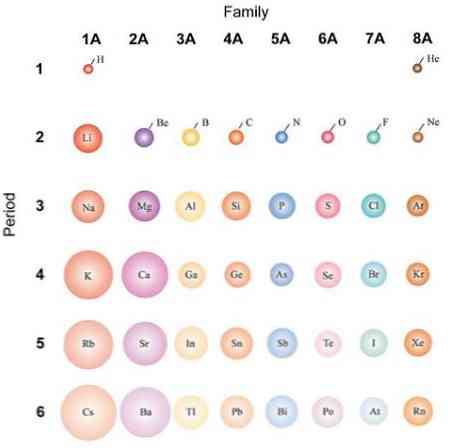
إذا تم اعتبار الذرات كروية ، فسيكون تباينها كما هو ملاحظ في نصف القطر الذري. في الصورة العلوية ، التي توضح العناصر التمثيلية ، يتضح أنه من اليمين إلى اليسار تتفشى الذرات ؛ بدلاً من ذلك ، من الأعلى إلى الأسفل تصبح هذه أكثر ضخامة.
هذا لأنه في نفس الفترة تضم النواة البروتونات وهي تتحرك إلى اليمين. هذه البروتونات تمارس قوة جذابة على الإلكترونات الخارجية ، والتي تشعر بأنها شحنة نووية فعالة Zممثل المؤسسة, أقل من الشحنة النووية الفعلية Z.
تقوم إلكترونات الطبقات الداخلية بصد تلك الطبقة الخارجية ، مما يقلل من تأثير النواة عليها ؛ هذا هو المعروف باسم تأثير الشاشة. في نفس الفترة ، لا ينجح تأثير الشاشة في مواجهة الزيادة في عدد البروتونات ، وبالتالي لا تمنع الإلكترونات الموجودة في الطبقة الداخلية من تقلص الذرات.
ومع ذلك ، بالنزول إلى مجموعة ، يتم تمكين مستويات جديدة من الطاقة ، والتي تسمح للإلكترونات بالمدار بعيدًا عن النواة. بالإضافة إلى ذلك ، يزداد عدد الإلكترونات في الطبقة الداخلية ، التي تبدأ آثارها في التدهور في التضاؤل إذا أضافت النواة البروتونات مرة أخرى.
لهذه الأسباب ، يمكن ملاحظة أن المجموعة 1 أ تحتوي على أكثر الذرات كثافة ، على عكس ذرات المجموعة 8 أ (أو 18) ذرات الغازات النبيلة.
الكميات الذرية للمعادن الانتقالية
ذرات الفلزات الانتقالية تدمج الإلكترونات في المدارات الداخلية د. يتم إلغاء هذه الزيادة في تأثير الشاشة وكذلك الشحنة النووية الحقيقية Z ، بشكل متساوٍ تقريبًا ، بحيث تحتفظ ذراتها بنفس حجمها في نفس الفترة.
بمعنى آخر: في فترة ما ، تظهر الفلزات الانتقالية أحجامًا ذرية مماثلة. ومع ذلك ، فإن هذه الاختلافات الصغيرة لها أهمية كبيرة عند تحديد البلورات المعدنية (كما لو كانت رخامية معدنية).
أمثلة
تتوفر صيغتان رياضيتان لحساب الحجم الذري لعنصر ، كل واحدة مع الأمثلة المقابلة لها.
مثال 1
بالنظر إلى دائرة نصف قطرها الذري للهيدروجين - 37 م (1 picometer = 10-12م) - والسيزيوم -265 مساءً- ، احسب أحجامها الذرية.
باستخدام صيغة المجلد الكروي ، لدينا:
VH= (4/3) (3.14) (37 مساءً)3= 212.07 مساءً3
Vخدمات العملاء= (4/3) (3.14) (265 م)3= 77912297673
ومع ذلك ، فإن تلك الكميات التي يتم التعبير عنها بالبيرومترات باهظة ، بحيث يتم تحويلها إلى وحدات من الأنجستروم ، مما يضاعفها بعامل التحويل (1Å / 100 مساءً)3:
(212.07 مساءً3) (1/100 م)3= 2.1207 × 10-4 Å3
(77912297،67 م3) (1/100 م)3= 77912 Å3
وهكذا ، فإن الاختلافات في الحجم بين ذرة H الصغيرة والذرة الضخمة لـ Cs تظل واضحة عدديًا. يجب أن يؤخذ في الاعتبار أن هذه الحسابات هي فقط تقريبية تحت ادعاء أن الذرة كروية تمامًا ، والتي تتجول في وجه الواقع.
مثال 2

كثافة الذهب الخالص 19.32 جم / مل وكتلته المولية 196.97 جم / مول. تطبيق الصيغة M / D لحساب حجم ذرة واحدة من ذرات الذهب يحتوي على ما يلي:
Vالاتحاد الافريقي= (196.97 جم / مول) / (19.32 جم / مل) = 10.19 مل / مول
أي أن ذرة واحدة من ذرات الذهب تشغل 10.19 مل ، ولكن ما حجم ذرة الذهب التي تشغلها على وجه التحديد؟ وكيفية التعبير عنها بوحدات الساعة3? لهذا ببساطة قم بتطبيق عوامل التحويل التالية:
(10.19 مل / مول) · (مول / 6.02 · 10)-23 ذرات) · (1 م / 100 سم)3· (1 بعد الظهر / 10-12م)3= 16،92 · 106 مساء3
من ناحية أخرى ، يبلغ نصف قطر الذهب الذري 166 م. إذا قارنت كلا المجلدين - المجلد الذي تم الحصول عليه بالطريقة السابقة والمجلد المحسوب مع صيغة المجلد الكروي - فستجد أنهما ليس لهما نفس القيمة:
Vالاتحاد الافريقي= (4/3) (3.14) (166 مساءً)3= 19.15 · 106 مساء3
أي من الاثنين هو الأقرب إلى القيمة المقبولة؟ الأقرب إلى النتائج التجريبية التي تم الحصول عليها بواسطة حيود الأشعة السينية للهيكل البلوري للذهب.
مراجع
- Helmenstine ، آن ماري ، دكتوراه (09 كانون الأول (ديسمبر) 2017. تعريف الحجم الذري. تم الاسترجاع في 6 يونيو ، 2018 ، من: thinkco.com
- مايفير ، أندرو. (13 مارس 2018). كيفية حساب حجم ذرة. sciencing. تم الاسترجاع في 6 يونيو ، 2018 ، من: sciencing.com
- ويكي كيدز ليمتد (2018). لوثار ماير منحنيات الحجم الذري. تم الاسترجاع في 6 يونيو ، 2018 ، من: wonderwhizkids.com
- التجويف. الاتجاهات الدورية: نصف القطر الذري. تم الاسترجاع في 6 يونيو ، 2018 ، من: courses.lumenlearning.com
- كاميلو ديربيتش. الحجم والكثافة الذرية. تم الاسترجاع في 6 يونيو ، 2018 ، من: es-puraquimica.weebly.com
- بياض ، ديفيس ، بيك وستانلي. الكيمياء. (الطبعة الثامنة). CENGAGE التعلم ، ص 222-224.
- CK-12 Foundation. (22 فبراير 2010). الأحجام الذرية المقارنة. [الشكل]. تم الاسترجاع في 6 يونيو 2018 ، من: commons.wikimedia.org
- CK-12 Foundation. (22 فبراير 2010). نصف القطر الذري لـ H2. [الشكل]. تم الاسترجاع في 6 يونيو 2018 ، من: commons.wikimedia.org


