هيكل أكسيد الفضة (Ag2O) ، والخصائص ، والتسميات والاستخدامات
ال أكسيد الفضة هو مركب غير عضوي الصيغة الكيميائية هي Ag2القوة التي توحد ذراتها هي ذات طبيعة أيونية بالكامل ؛ لذلك ، يتكون من مادة صلبة أيونية حيث توجد نسبة من كاتيونات Ag+ التفاعل الكهربائي مع أنيون O2-.
أنيون أكسيد ، يا2-, ينتج عن تفاعل الذرات الفضية للسطح مع أكسجين البيئة ؛ بطريقة مشابهة جدا للحديد والعديد من المعادن الأخرى. قطعة فضية أو مجوهرات فضية بدلاً من التحمر وتنهار في الصدأ ، تتحول إلى اللون الأسود ، وهي سمة من أكسيد الفضة.

على سبيل المثال ، في الصورة أعلاه يمكنك أن ترى كوبًا من الفضة الصدئة. لاحظ سطحه الأسود ، على الرغم من أنه لا يزال يحتفظ ببعض اللمعان الزيتي ؛ وهذا هو السبب في أنه يمكن اعتبار الأجسام الفضية الصدئة جذابة بدرجة كافية للاستخدامات الزخرفية.
خصائص أكسيد الفضة هي أنها لا تفسد ، لأول وهلة ، السطح المعدني الأصلي. تتشكل في درجة حرارة الغرفة عن طريق ملامسة بسيطة للأكسجين في الهواء. والأكثر إثارة للاهتمام ، يمكن أن تتحلل في درجات حرارة عالية (فوق 200 درجة مئوية).
هذا يعني أنه إذا تم الاحتفاظ بزجاج الصورة ، وتم استخدام حرارة اللهب الشديد ، فسوف تستعيد لمعانها الفضي. لذلك ، تشكيله هو عملية عكسها ديناميكا حرارية.
يحتوي أكسيد الفضة أيضًا على خصائص أخرى ، بالإضافة إلى تركيبة Ag البسيطة2أو ، يشمل المنظمات الهيكلية المعقدة ومجموعة متنوعة غنية من المواد الصلبة. ومع ذلك ، فإن Ag2أم أنها ربما ، بجانب Ag2O3, الأكثر تمثيلا لأكاسيد الفضة.
مؤشر
- 1 هيكل أكسيد الفضة
- 1.1 التغييرات مع عدد فالنسيا
- 2 الخصائص الفيزيائية والكيميائية
- 2.1 الوزن الجزيئي
- 2.2 المظهر
- 2.3 الكثافة
- 2.4 نقطة انصهار
- 2.5 كيلوبت في الثانية
- 2.6 الذوبان
- 2.7 شخصية تساهمية
- 2.8 التحلل
- 3 تسميات
- 3.1 فالنسياس الأول والثالث
- 3.2 تسميات منهجية لأكاسيد الفضة المعقدة
- 4 الاستخدامات
- 5 المراجع
هيكل أكسيد الفضة
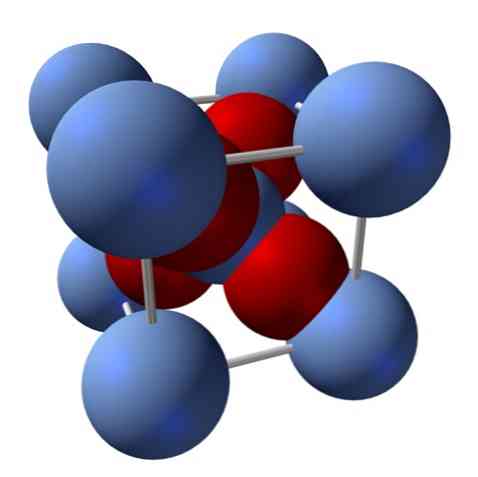
كيف هو هيكلها؟ كما ذكرنا في البداية: إنها مادة صلبة أيونية. لهذا السبب ، لا يمكن أن توجد روابط تساهمية Ag - O ولا Ag = O في بنيتها ؛ لأنه ، إذا كان هناك ، فإن خصائص هذا أكسيد تتغير بشكل كبير. ومن ثم أيونات Ag+ و يا2- في نسبة 2: 1 وتشهد جاذبية كهرباء.
يتم تحديد هيكل أكسيد الفضة نتيجة للطريقة التي تتخلص بها القوى الأيونية في الفضاء أيونات Ag+ و يا2-.
في الصورة العليا ، على سبيل المثال ، لديك خلية وحدة لنظام بلوري مكعب: الكاتيونات Ag+ هي المجالات الفضية الزرقاء ، و O2- المجالات المحمر.
إذا قمت بحساب عدد المجالات ، ستجد أن هناك ، للوهلة الأولى ، تسعة من الألوان الزرقاء الفضية وأربعة ألوان حمراء. ومع ذلك ، فقط شظايا المجالات الموجودة داخل المكعب تؤخذ بعين الاعتبار ؛ لحساب هذه ، كونها كسور من مجموع المجالات ، يجب استيفاء نسبة 2: 1 لـ Ag2O.
تكرار الوحدة الهيكلية من رباعي السطوح آغو4 محاط بأربعة أغ+, تم بناء جميع المواد الصلبة السوداء (لتفادي الفجوات أو المخالفات التي يمكن أن تنطوي عليها هذه الترتيبات البلورية).
يتغير مع عدد فالنسيا
مع التركيز الآن ليس على رباعي السطوح AgO4 ولكن في الخط AgOAg (لاحظ رؤوس المكعب العلوي) ، سيكون تكوين أكسيد الفضة الصلب ، من منظور آخر ، لطبقات أيون متعددة مرتبة خطياً (على الرغم من ميلها). كل هذا نتيجة للهندسة "الجزيئية" حول Ag+.
تم تأكيد ما سبق من خلال العديد من الدراسات حول بنيته الأيونية.
تعمل الفضة بشكل أساسي مع التكافؤ +1 ، لأنه عند فقد الإلكترون ، يكون التكوين الإلكتروني الناتج هو [Kr] 4d10, وهو مستقر جدا. التكافؤ الأخرى ، مثل Ag2+ و Ag3+ فهي أقل استقرارًا لأنها تفقد الإلكترونات من المدارات ممتلئة بالكامل تقريبًا.
آغ أيون3+, ومع ذلك ، فإنه أقل استقرارًا نسبيًا مقارنة بـ Ag2+. في الواقع ، يمكن أن تتعايش في شركة Ag+ إثراء هيكل كيميائيا.
التكوين الإلكتروني هو [Kr] 4d8, مع الإلكترونات غير المبرمة بطريقة تعطيه بعض الاستقرار.
على عكس الأشكال الهندسية الخطية حول أيونات Ag+, لقد وجد أن أيونات Ag3+ إنه مربع مسطح. لذلك ، أكسيد الفضة مع أيونات Ag3+ سوف تتكون من طبقات تتألف من مربعات AgO4 (وليس رباعي الاسطح) مرتبط كهربائيا بخطوط AgOAg ؛ هذه هي حالة Ag4O4 أو حج2O ∙ Ag2O3 مع هيكل أحادي.
الخصائص الفيزيائية والكيميائية

إذا كنت تخدش سطح الكأس الفضي في الصورة الرئيسية ، فستحصل على مادة صلبة ليست سوداء فحسب ، بل لها نغمات بنية أو بنية اللون (الصورة العليا). فيما يلي بعض الخصائص الفيزيائية والكيميائية التي أبلغت عنها هذه اللحظات:
الوزن الجزيئي
231،735 جم / مول
مظهر
اللون البني الأسود الصلب في شكل مسحوق (لاحظ أنه على الرغم من كونه صلبًا أيونيًا ، إلا أنه يفتقر إلى المظهر البلوري). إنه عديم الرائحة ويمزج مع الماء ويعطيه طعمًا معدنيًا
كثافة
7.14 جم / مل.
نقطة انصهار
277-300 درجة مئوية بالتأكيد ، يذوب في الفضة الصلبة. وهذا هو ، ربما ينهار قبل تشكيل أكسيد السائل.
شرطة كوسوفو
1.52 ∙ 10-8 في الماء عند 20 درجة مئوية لذلك فهو مركب بالكاد قابل للذوبان في الماء.
الذوبانية
إذا نظرت بعناية إلى صورة هيكلها ستجد أن أجواء Ag2+ و يا2- انهم لا يختلفون تقريبا في الحجم. نتيجة لذلك ، يمكن فقط لجزيئات صغيرة اختراق داخل الشبكة البلورية ، مما يجعلها غير قابلة للذوبان في جميع المذيبات تقريبا ؛ باستثناء تلك التي يتفاعل فيها ، مثل القواعد والأحماض.
شخصية تساهمية
رغم أنه قيل مرارًا وتكرارًا أن أكسيد الفضة مركب أيوني ، فإن بعض الخصائص ، مثل نقطة انصهاره المنخفضة ، تتناقض مع هذا البيان.
من المؤكد أن النظر في الشخصية التساهمية لا ينهار ما هو موضح لهيكلها ، سيكون كافياً لإضافته إلى هيكل Ag2أو نموذج من المجالات والحانات للإشارة إلى الروابط التساهمية.
أيضا ، رباعي الاسطح والطائرات مربع آغو4, بالإضافة إلى خطوط AgOAg ، سيتم ربطها بروابط تساهمية (أو أيونية تساهمية).
مع هذا في الاعتبار ، و Ag2أو سيكون في الواقع البوليمر. ومع ذلك ، فمن المستحسن اعتباره كمادة صلبة أيونية ذات طابع تساهمي (الذي طبيعة الارتباط لا يزال يمثل تحديا في الوقت الحاضر).
التحلل
في البداية ، تم ذكر أن تكوينها قابل للانعكاس ديناميكيًا ، لذلك تمتص الحرارة للعودة إلى حالتها المعدنية. كل هذا يمكن التعبير عنه بمعادلتين كيميائيتين لمثل هذه التفاعلات:
4Ag (ق) + O2(g) => 2Ag2يا (ق) + س
2AG2O (s) + Q => 4Ag (s) + O2(G)
حيث يمثل Q الحرارة في المعادلة. هذا ما يفسر سبب إحراق النار التي تحترق سطح الكأس الفضي الصدأ بريقها الفضي.
لذلك ، من الصعب افتراض أن هناك Ag2O (ل) لأنه سيتحلل على الفور بالحرارة ؛ ما لم يكن الضغط مرتفعًا جدًا للحصول على السائل البني الأسود المذكور.
تسمية
عندما تم عرض إمكانية أيونات Ag2+ و Ag3+ إلى جانب AG المشتركة والسائدة+, يبدو مصطلح "أكسيد الفضة" غير كافٍ للإشارة إلى Ag2O.
وذلك لأن أيون حج+ أكثر وفرة من الآخرين ، لذلك يتم أخذ Ag2أو كما أكسيد الوحيد. وهو غير صحيح على الإطلاق.
إذا كنت تفكر في Ag2+ نظرًا لعدم وجودها عمليًا نظرًا لعدم استقرارها ، فلن يكون هناك سوى الأيونات ذات التكافؤ +1 و +3. أي Ag (I) و Ag (III).
فالنسياس الأول والثالث
كونه Ag (I) أقل التكافؤ ، تتم تسميته بإضافة اللاحقة -oso إلى اسمه فضة. لذلك ، Ag2أو هو: أكسيد الأرجنتوس أو ، وفقًا للتسمية المنهجية ، أول أكسيد الدبلومة.
إذا تم تجاهل Ag (III) تمامًا ، فيجب أن تكون تسمياتها التقليدية: أكسيد الفضة بدلاً من أكسيد الأرجنتين.
من ناحية أخرى ، يتم إضافة Ag (III) كونها أكبر التكافؤ لاحقة -ico لاسمها. لذلك ، Ag2O3 هو: أكسيد الفضة (2 أيونات أيغ)3+ مع ثلاثة O2-). أيضا ، فإن اسمها وفقا للتسمية منهجية سيكون: دبلومة ثالث شهادة.
إذا لوحظ هيكل Ag2O3, يمكن افتراض أنه نتاج الأكسدة بواسطة الأوزون ، أو3, بدلا من الأكسجين. لذلك ، يجب أن يكون طابعها التساهمي أكبر لأنه مركب تساهمي يحتوي على روابط Ag-O-O-O-Ag أو Ag-O.3-حج.
تسميات منهجية لأكاسيد الفضة المعقدة
و AgO ، كما كتبته Ag4O4 أو حج2O ∙ Ag2O3, إنه أكسيد الفضة (I ، III) ، لأنه يحتوي على كل من التكافؤ +1 و +3. اسمها وفقًا للتسمية المنهجية سيكون: رباعي أكسيد رباعي الصفيح.
هذه التسمية مفيدة للغاية عندما يتعلق الأمر بأكاسيد الفضة الأكثر تعقيدًا بطريقة متكافئة. على سبيل المثال ، افترض أن اثنين من المواد الصلبة 2Ag2O ∙ Ag2O3 و Ag2O ∙ 3Ag2O3.
كتابة أول واحد بطريقة أكثر ملاءمة سيكون: Ag6O5 (عد وإضافة ذرات Ag و O). سيكون اسمه ثم hexaplate بنتوكسيد. لاحظ أن هذا أكسيد يحتوي على تكوين الفضة أقل ثراء من Ag2يا (6: 5) < 2:1).
أثناء كتابة المادة الصلبة الثانية على خلاف ذلك ، سيكون: Ag8O10. سيكون اسمه ديبوكسايد الثماني أكسيد (بنسبة 8:10 أو نسبة 4: 5). سيكون أكسيد الفضة الإفتراضي "مؤكسدًا جدًا".
تطبيقات
الدراسات التي تبحث عن استخدامات جديدة ومتطورة لأكسيد الفضة لا تزال جارية حتى الآن. بعض استخداماته مذكورة أدناه:
-يذوب في الأمونيا ، نترات الأمونيوم والماء لتشكيل كاشف Tollens. هذا الكاشف هو أداة مفيدة في التحليلات النوعية داخل مختبرات الكيمياء العضوية. يسمح بتحديد وجود الألدهيدات في عينة ، والاستجابة الإيجابية تتمثل في تكوين "مرآة فضية" في أنبوب الاختبار.
-جنبا إلى جنب مع الزنك المعدني فإنه يشكل البطاريات الأساسية لأكسيد الزنك من الفضة. ربما يكون هذا أحد الاستخدامات الأكثر شيوعًا وعائلي.
-وهو بمثابة تنقية الغاز ، واستيعاب على سبيل المثال CO2. عند التسخين ، تطلق الغازات المحتجزة ويمكن إعادة استخدامها عدة مرات.
-نظرًا لخصائص الفضة المضادة للميكروبات ، فإن أكسيدها مفيد في دراسات التحليل الحيوي وتنقية التربة.
-وهو عامل مؤكسد خفيف قادر على أكسدة الألدهيدات إلى أحماض كربوكسيلية. يستخدم أيضًا في تفاعل هوفمان (الأمينات الثلاثية) ويشارك في التفاعلات العضوية الأخرى ، إما كاشف أو محفز.
مراجع
- Bergstresser M. (2018). أكسيد الفضة: الصيغة ، التحلل والتشكيل. الدراسة. تم الاسترجاع من: study.com
- مؤلفو ومحررو المجلدات III / 17E-17F-41C. (بدون تاريخ). أكاسيد الفضة (Ag (x) O (y)) هيكل بلوري ، بارامترات شعرية. (البيانات العددية والعلاقات الوظيفية في العلوم والتكنولوجيا) ، المجلد 41C. سبرينغر ، برلين ، هايدلبرغ.
- ماهيندرا كومار تريفيدي ، راما موهان تالابراجادا ، أليس برانتون ، داهرين تريفيدي ، جوبال ناياك ، أمبراكاش لاتيال ، سنحاسيس جانا. (2015). التأثير المحتمل لمعالجة الطاقة الحيوية في الخواص الفيزيائية والحرارية لمسحوق أكسيد الفضة. المجلة الدولية للعلوم والهندسة الطبية الحيوية. المجلد 3 ، رقم 5 ، ص. 62-68. Doi: 10.11648 / j.ijbse.20150305.11
- سوليفان ر. (2012). تحلل أكسيد الفضة. جامعة أوريغون تم الاسترجاع من: chemdemos.uoregon.edu
- فلينت ، دياندا. (24 أبريل 2014). استخدامات بطاريات أكسيد الفضة. Sciencing. تم الاسترجاع من: sciencing.com
- سلمان منتصر E. (2016). دراسة بعض الخصائص البصرية لأكسيد الفضة (Ag2o) باستخدام مقياس الطيف الضوئي UVVisible. [PDF]. تم الاسترجاع من: iosrjournals.org
- Bard Allen J. (1985). إمكانات القياسية في محلول مائي. مارسيل ديكر. تم الاسترجاع من: books.google.co.ve


