داء المثقبيات بروسي الخصائص ، التشكل ، الدورة البيولوجية ، والأعراض
داء المثقبيات بروسي إنه طفيل خارج الخلية. ينتمي إلى فئة Kinetoplastidae ، جنس عائلة المثقبيات المثقبيات. هناك نوعان من السلالات التي تسبب نوعين مختلفين من داء المثقبيات البشري الأفريقي أو تسمى أيضًا "مرض النوم".
داء المثقبيات بروسي subsp. الغامبية, يسبب الشكل المزمن و 98 ٪ من الحالات ، وتقع في غرب ووسط أفريقيا جنوب الصحراء الكبرى. داء المثقبيات بروسي subsp. الروديسية هو السبب في الشكل الحاد ، الموجود في وسط وشرق أفريقيا جنوب الصحراء الكبرى.
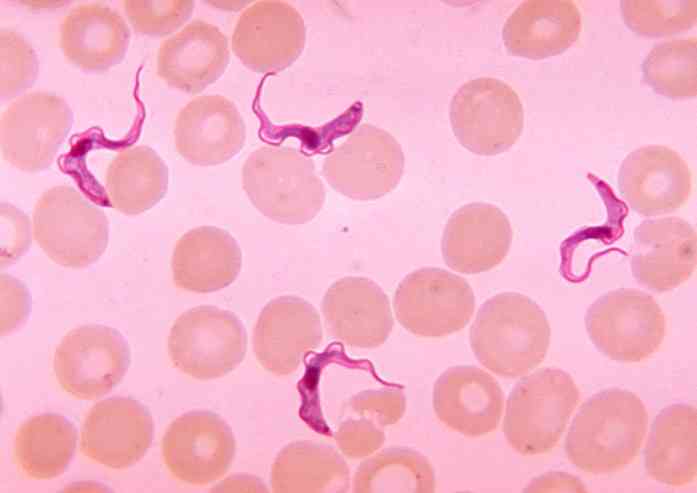
تم الإبلاغ عن كلا النوعين من هذا المرض في بلدان إفريقيا جنوب الصحراء حيث توجد ذبابة تسي تسي, Glossina spp, ناقل أو وكيل الإرسال من ت. بروسي.
سلالات ثالثة, داء المثقبيات بروسي subsp. البروسية, يسبب مرض مماثل في الحيوانات الأليفة والبرية ، ودعا nagana.
يهدد "مرض النوم" أكثر من 60 مليون شخص في 36 دولة في أفريقيا جنوب الصحراء الكبرى. هناك ما يقرب من 300000 إلى 500000 حالة في السنة ، منها حوالي 70،000 إلى 100،000 حالة وفاة. ويغطي تفشي ذبابة تسي تسي مساحة 10 ملايين كيلومتر مربع ، أي ثلث مساحة أفريقيا.
تعترف منظمة الصحة العالمية بانخفاض كبير في عدد الحالات الجديدة لمرض التريبانوزوما البشري الأفريقي في السنوات الأخيرة. ويرجع ذلك إلى استمرار المبادرات الوطنية والدولية لمكافحة هذا المرض.
مؤشر
- 1 الخصائص العامة
- 1.1 الاكتشاف
- 1.2 علم الوراثة
- 1.3 "مرض النوم" والاحتباس الحراري
- 2 السلالات والتصنيف
- 3 التشكل
- 3.1 نموذج Tryomastigote
- 3.2 نموذج Epimastigote
- 3.3 الحركية
- 4 الدورة البيولوجية
- 4.1 في المضيف (الإنسان أو الثدييات الأخرى)
- 4.2 في ذبابة تسي تسي (المتجه)
- 5 أعراض العدوى
- 5.1 المرحلة الأولى
- 5.2 المرحلة الثانية
- 5.3 التشخيص
- 6 علاج
- 7 المراجع
الخصائص العامة
يطلق عليه "مرض النوم" لأنه يسبب انعكاس دورة النوم الطبيعية للمريض. ينام الشخص أثناء النهار ويبقى مستيقظًا في الليل. هذا هو نتاج سلسلة من الاضطرابات النفسية والعصبية التي يسببها المرض في مرحلته المتقدمة.
الاكتشاف
داء المثقبيات الحيوانية أو الناغانية مرض مهم في الماشية في إفريقيا. عرف نفسه داء المثقبيات بروسي كعامل سببي في عام 1899. كان ديفيد بروس أثناء التحقيق في اندلاع كبير لل Nagana في Zululand.
في وقت لاحق ، حدد ألدو كاستيلاني هذا النوع من المثقبيات في الدم والسائل النخاعي للمرضى الذين يعانون من "مرض النوم".
بين عامي 1902 و 1910 ، تم تحديد نوعين مختلفين من المرض في البشر ونوعهما المسبب. يمكن أن تعمل كل من الحيوانات والبشر كخزانات للطفيليات قادرة على التسبب في المرض لدى البشر.
علم الوراثة
جينوم نواة داء المثقبيات بروسي وهي مكونة من 11 كروموسومات ثنائية الصبغيات ومئات من الكروموسومات. في المجموع لديها 9068 الجينات. يتكون جينوم الميتوكوندريا (الحركية) من نسخ عديدة من الدنا الدائري.
"مرض النوم" والاحتباس الحراري
يعتبر داء المثقبيات البشري الأفريقي أحد الأمراض المعدية البشرية الـ 12 التي يمكن أن تتفاقم بسبب الاحتباس الحراري.
ويرجع ذلك إلى حقيقة أنه عندما تزداد درجة الحرارة المحيطة ، سيتم توسيع المنطقة المعرضة للانشغال بالذبابة. Glossina sp. عند استعمار المناطق المتطايرة الجديدة ، سيستغرق الأمر الطفيلي.
التطابق والتصنيف
المثقبيات بروسي صينتمي إلى مملكة Protista، مجموعة Excavata، phylum Euglenozoa، الفئة Kinetoplastidae، طلب Trypanosomatida، عائلة Trypanosomatidae، جنس المثقبيات, مناحي Tripanozoon.
يحتوي هذا النوع على ثلاثة سلالات تسبب أنواع مختلفة من "مرض النوم" عند البشر (ت. ب. subsp. الغامبية و ت. ب. subsp. صhodesiense) وفي الحيوانات الأليفة والبرية (ت. ب. subsp. البروسية).
مورفولوجيا
شكل ترايبوماستيجوتي
داء المثقبيات بروسي هو كائن وحيد الخلية ممدود يبلغ طوله 20 ميكرون وعرضه 1-3 ميكرومتر ، يختلف شكله وتركيبه وغشاءه طوال دورة حياته.
له شكلان أساسيان. شكل ثلاثي الأضلاع من الجسم القاعدي الخلفي للنواة والسوط الطويل. يفترض هذا النموذج بدوره الأنواع الفرعية خلال دورة الحياة. من هؤلاء ، النوع الفرعي القصير أو القصير (slumpy باللغة الإنجليزية) ، هو أكثر سمكا وجلدها قصير.
شكل Epimastigote
الشكل الأساسي الثاني هو epimastigote للجسم القاعدي الأمامي للنواة والجلد القصير إلى حد ما عن سابقته.
تمت تغطية الخلية بطبقة من البروتين سكري السطح. هذه الطبقة تغير البروتينات السكرية من سطحها وبالتالي يراوغ هجوم الأجسام المضادة الناتجة عن المضيف.
ينتج الجهاز المناعي أجسامًا مضادة جديدة لمهاجمة التكوين الجديد للطبقة وتتغير الطبقة مرة أخرى. هذا هو ما يسمى الاختلاف مستضد.
الحركية
سمة مهمة هي وجود الورم الحركي. يتكون هذا الهيكل من الحمض النووي المتكثف الموجود داخل الميتوكوندريا فقط. تقع هذه الميتوكوندريا الكبيرة في قاعدة البلاء.
الدورة البيولوجية
دورة حياة داء المثقبيات بروسي يتناوب بين ذبابة تسي تسي باعتباره ناقلًا والإنسان كمضيف. لتطوير في مثل هذه المضيفين مختلفة ، يخضع البروتوزون تغييرات التمثيل الغذائي والمورفولوجية الهامة من واحد إلى آخر.
في الطاير ، و داء المثقبيات بروسي يسكن الجهاز الهضمي ، بينما في الكائن البشري يوجد في الدم.
في المضيف (الإنسان أو غيرها من الثدييات)
داء المثقبيات بروسي ويأتي في ثلاثة أشكال أساسية طوال دورته. عندما تعض الذبابة الإنسان أو الثدييات الأخرى لاستخراج دمها ، فإنها تحقن من الغدد اللعابية في مجرى الدم شكلًا غير تكاثري من البروتوزوان ، يطلق عليه metacyclic.
مرة واحدة في مجرى الدم ، يتحول إلى شكل تكاثري ، يسمى الدم النحيل (مرهف باللغة الإنجليزية).
شكل الدم النحيل من داء المثقبيات بروسي يحصل على الطاقة من تحلل السكر في الدم الموجود في الدم. تتم هذه العملية الأيضية في عضية تسمى الجليكوزوما. تتكاثر هذه المثقبيات في سوائل الجسم المختلفة: الدم ، والليمفاوي ، والسائل النخاعي.
مع زيادة عدد الطفيليات في الدم ، فإنها تبدأ في التحول مرة أخرى إلى شكل غير التكاثري. هذه المرة هو متغير أكثر سمكا مع سوط أقصر ، ودعا الدم ممتلئ الجسم (قصير).
يتم تكييف المثقبيات الدرنية في الدم لظروف الجهاز الهضمي للذبابة. أنها تنشط الميتوكوندريا والأنزيمات اللازمة لدورة الأحماض الستريك وسلسلة الجهاز التنفسي. مصدر الطاقة لم يعد الجلوكوز ولكن البرولين.
في ذبابة تسي تسي (ناقل)
ناقل أو وكيل الإرسال من داء المثقبيات بروسي انها ذبابة تسي تسي, Glossina spp. يضم هذا الجنس 25 إلى 30 نوعًا من الذباب الدموي. إنها سهلة التفريق عن الذبابة الشائعة عن طريق خرطوم طويل خاص بها وأجنحتها المطوية بالكامل أثناء الراحة.
عندما تعض ذبابة تسي تسي على الثدييات المضيفة المصابة وتستخرج الدم ، تخترق هذه الأشكال الدموية الحاملة المتجه..
مرة واحدة في الجهاز الهضمي من الذبابة ، أشكال الدم الغليظة بسرعة تميز في المثقبيات التكاثري التكاثري.
تتضاعف الانشطار الثنائي. يغادرون الجهاز الهضمي من الذبابة ويذهبون إلى الغدد اللعابية. يتم تحويلها إلى epimastigotes التي ترسو على الجدران من قبل البلاء.
في الغدد اللعابية ، تتكاثر وتتحول إلى المثقبيات الميتاسية الحلقية ، جاهزة للتلقيح مرة أخرى في نظام الدم للثدييات.
أعراض العدوى
فترة الحضانة لهذا المرض هي 2 إلى 3 أيام بعد لدغة الذبابة. قد تحدث الأعراض العصبية بعد بضعة أشهر في حالة T. b. subsp. الغامبية. إذا كان الأمر كذلك ت. ب. subsp. الروديسية, قد يستغرق الأمر سنوات لتظهر.
المرحلة الأولى
يحتوي "مرض النوم" على مرحلتين. الأولى تسمى المرحلة المبكرة أو المرحلة الهيموليمفية ، وتتميز بوجود داء المثقبيات بروسي فقط في الدم والليمفاوية.
في هذه الحالة ، تكون الأعراض هي الحمى والصداع وآلام العضلات والقيء والغدد الليمفاوية المتضخمة وفقدان الوزن والضعف والتهيج.
في هذه المرحلة ، يمكن الخلط بين المرض والملاريا.
المرحلة الثانية
يتم تنشيط ما يسمى المرحلة المتأخرة أو المرحلة العصبية (الحالة الدماغية) ، مع وصول الطفيلي إلى الجهاز العصبي المركزي ، ويتم اكتشافه في السائل النخاعي الشوكي. يتم التعبير عن الأعراض هنا كتغيرات في السلوك والارتباك وعدم الاتساق وتغيير دورة النوم وأخيراً الغيبوبة.
يستمر تطور المرض مع دورة تصل إلى ثلاث سنوات في حالة الأنواع الفرعية الغامبية, تنتهي مع الموت. عندما الأنواع الفرعية موجودة الروديسية, الموت يأتي من أسابيع إلى أشهر.
من الحالات التي لا تخضع للعلاج ، يموت 100 ٪. 2-8 ٪ من الحالات المعالجة تموت أيضا.
التشخيص
المرحلة التشخيصية هي عندما يكون الشكل المعدي ، أي التريبانوزوم في الدم ، موجودًا في الدم.
عن طريق الفحص المجهري لعينات الدم ، يتم اكتشاف الشكل المحدد للطفيلي. في المرحلة الدماغية ، يلزم إجراء ثقب في الفقرات القطنية لتحليل السائل النخاعي.
هناك العديد من التقنيات الجزيئية لتشخيص وجود داء المثقبيات بروسي.
علاج
القدرة التي لديها داء المثقبيات بروسي التغير المستمر في تكوين الطبقة الخارجية من البروتينات السكرية (التغير المضاد) ، يجعل من الصعب للغاية تطوير لقاحات ضد "مرض النوم".
لا يوجد علاج كيميائي وقائي أو احتمال ضئيل أو معدوم للقاح. الأدوية الأربعة الرئيسية المستخدمة في داء المثقبيات الأفريقي البشري سامة.
ميلارسوبرول هو الدواء الوحيد الفعال لكلا النوعين من مرض الجهاز العصبي المركزي. ومع ذلك ، فهي سامة لدرجة أنها تقتل 5 ٪ من المرضى الذين يتلقونها.
يستخدم الإفلورنيثين ، بمفرده أو بالاشتراك مع النيفورتيموكس ، كخط أول من العلاج لهذا المرض الناجم عن داء المثقبيات بروسي subsp. الغامبية.
مراجع
- Fenn K and KR Matthews (2007) بيولوجيا الخلية للتمايز بروسيبان التريبانوزوما. الرأي الحالي في علم الأحياء الدقيقة. 10: 539-546.
- Fernández-Moya SM (2013) التوصيف الوظيفي لبروتينات الارتباط RNA RBP33 و DRBD3 كمنظمين للتعبير الجيني لـ داء المثقبيات بروسي. أطروحة دكتوراه. معهد علم الطفيليات والطب الحيوي "لوبيز-نيرا". افتتاحية جامعة غرناطة ، إسبانيا. 189 ص.
- García-Salcedo JA، D Pérez-Morga، P Gijón، V Dilbeck، E Pays and DP Nolan (2004) A A different differential actin for actin through the life life of Trypanosoma brucei The EMBO Journal 23: 780-789.
- كينيدي PGE (2008) استمرار مشكلة داء المثقبيات الأفريقي البشري (مرض النوم). حوليات الأعصاب ، 64 (2) ، 116-126.
- ماثيوز KR (2005) بيولوجيا الخلية التنموية داء المثقبيات بروسي. J. Cell Sci. 118: 283-290.
- Welburn SC، EM Fèvre، PG Coleman، M Odiit and I Maudlin (2001) Sleeping المرض: قصة من مرضين. الاتجاهات في علم الطفيليات. 17 (1): 19-24.


