الخصائص المميزة للمادة (الفيزيائية والكيميائية)
ال الخصائص المميزة للمادة إنها خواص كيميائية أو فيزيائية يمكنها المساعدة في تحديد أو تمييز مادة ما عن الأخرى. الخواص الفيزيائية هي خصائص مادة يتم ملاحظتها بالحواس. الخواص الكيميائية هي خصائص تصف كيف تتغير المادة من مادة إلى أخرى أثناء التفاعل الكيميائي.
بعض الخصائص الفيزيائية للمادة هي الكثافة ، الذوبان ، نقطة الانصهار ، اللون والكتلة. تشمل الخواص الكيميائية للمادة القابلية للاشتعال والتفاعل مع الأحماض والتآكل. بعض الأمثلة على كيفية مساعدة خصائص المادة في تحديد عنصر ما هي مقارنة كثافات العناصر المختلفة.
تبلغ كثافة عنصر مثل الذهب 19.3 جرامًا لكل سنتيمتر مكعب ، بينما تبلغ كثافة الكبريت 1.96 جرامًا لكل سنتيمتر مكعب. وبالمثل ، تختلف نقاط انصهار مواد مثل الماء وكحول الأيزوبروبيل.
الخصائص الفيزيائية للمادة
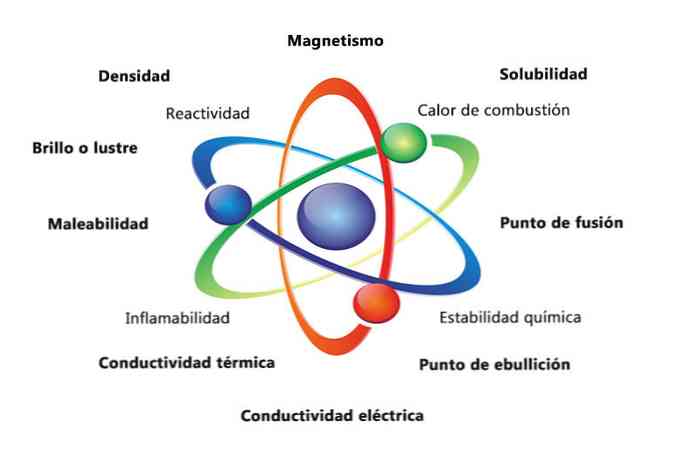
الخواص الفيزيائية للمادة هي خصائص يمكن قياسها أو ملاحظتها دون تغيير الطبيعة الكيميائية للمادة. بعض الأمثلة على الخصائص الفيزيائية هي:
- الكثافة: يتم احتساب مقدار المادة التي تحتوي على كائن بتقسيم الكتلة على الحجم.
- المغناطيسية: قوة الجذب بين المغناطيس والكائن المغناطيسي.
- القابلية للذوبان: قياس مدى قدرة المادة على الذوبان في مادة أخرى.
- نقطة الانصهار: درجة الحرارة التي تتغير فيها المادة من مادة صلبة إلى سائلة.
- درجة الغليان: درجة الحرارة التي تتغير فيها المادة من السائل إلى الغاز.
- التوصيل الكهربائي: هو مقياس لمدى حركة التيارات الكهربائية خلال مادة ما.
- الموصلية الحرارية: السرعة التي تنقل بها المادة الحرارة.
- قابلية الانتهاك: هي قدرة مادة ما على أن تدحرجت أو تُطحن بطرق مختلفة.
- اللمعان أو اللمعان: هو مدى سهولة انعكاس الكائن على الضوء.
الخواص الكيميائية للمادة
تصف الخواص الكيميائية قدرة المادة على تحويل نفسها إلى مادة جديدة ذات خواص مختلفة. فيما يلي العديد من الأمثلة على الخواص الكيميائية:
- حرارة الاحتراق: هي الطاقة المنبعثة عندما يخضع مركب للاحتراق الكامل بالأكسجين.
- الثبات الكيميائي: يشير إلى ما إذا كان المركب سيتفاعل مع الماء أو الهواء (المواد المستقرة كيميائياً لن تتفاعل).
- القابلية للاشتعال: قدرة المركب على الاحتراق عند تعرضه للهب.
- التفاعل: القدرة على التفاعل مع مادة أخرى وتشكيل مادة جديدة أو أكثر.
الحالات المادية للمادة
المسألة هي أي شيء يشغل حيزًا له كتلة ويمكن أن يتصورها حواسنا. يمكن تصنيف المادة وفقًا لحالتها الفيزيائية: صلبة وسائلة وغازية.
1- المواد الصلبة وخصائصها المميزة
جميع المواد الصلبة لها كتلة ، وتحتل مساحة ، ولها حجم وشكل محدد ، لا تنزلق عبر الفضاء ولا يمكن ضغطها أو أن يكون لها شكل صلب. كأمثلة لدينا: الخشب ، الكتب ، الإسفنج ، المعادن ، الأحجار ، إلخ..
في المواد الصلبة ، تكون الجزيئات الصغيرة من المادة قريبة جدًا من بعضها البعض وتلمس بعضها البعض. الجسيمات قريبة جدا من بعضها البعض بحيث لا يمكن أن تتحرك كثيرا ، وهناك مساحة صغيرة جدا بينهما.
2- السوائل وخصائصها المميزة
جميع السوائل لها كتلة ، وتحتل مساحة ، ولها حجم محدد ولكن ليس لها شكل محدد (نظرًا لتكيفها مع الحاوية الموجودة بها) ، يمكن ضغطها بدرجة صغيرة جدًا ويمكن أن تنزلق عبر الفضاء. كأمثلة لدينا: الماء ، الكيروسين ، الزيت ، إلخ..
في السوائل ، تكون الجزيئات الصغيرة من المادة بعيدة بعض الشيء عن بعضها البعض ، وهناك مساحة أكبر بينها (مقارنة بالمادة الصلبة) ولا تمس بعضها البعض. لذلك ، يمكن للجزيئات أن تتحرك بين مسافات ، تدفع وتصطدم بجزيئات أخرى ، وتغير اتجاهها باستمرار.
3- الغازات وخصائصها المميزة
جميع الغازات لها كتلة ، وتحتل مساحة ، وليس لها حجم محدد أو شكل ، ويمكن ضغطها إلى حد كبير ويمكن أن تنتشر في الفضاء. على سبيل المثال لدينا: الهيدروجين ، الأكسجين ، النيتروجين ، ثاني أكسيد الكربون ، البخار ، إلخ..
في الغازات ، تتفكك الجزيئات الصغيرة من المادة ، وهناك مساحة أكبر بكثير بينها (مقارنة بالسوائل) ولا تمس بعضها البعض. تتمتع الجسيمات بأقصى قدر من حرية الحركة بحيث تدفع وتتصادم مع جزيئات أخرى تتغير باستمرار في الاتجاه.
تغيرات الحالة
يمكن تحويل المادة من الحالة الصلبة إلى الحالة السائلة والعكس صحيح ، ومن الحالة السائلة إلى الحالة الغازية والعكس بالعكس. يأخذ هذا التحويل اسم تغيير حالة الأمر ويحدث بتغيرات في درجة الحرارة:
الاندماج
تغيير حالة المواد من الصلب إلى السائل عن طريق زيادة درجة الحرارة. عندما يتم تسخين مادة صلبة ، تتسبب الحرارة في اهتزاز الجزيئات بقوة أكبر.
عند الوصول إلى نقطة الانصهار ، تمتلك الجسيمات الصلبة طاقة حركية كافية للتغلب على قوى الجذب النشطة التي تمسكها بمواقع ثابتة ، وتتكسر لتشكل مجموعات صغيرة من الجزيئات السائلة..
الغليان أو التبخير
تغيير حالة المادة السائلة إلى غازية عن طريق زيادة درجة الحرارة. عندما يتم تسخين مادة سائلة ، تجعل الحرارة الجزيئات تتحرك بشكل أسرع.
عند الوصول إلى نقطة الغليان ، يكون للجزيئات السائلة طاقة حركية كافية للتغلب على قوى الجذب التي تحتفظ بها في مواقع ثابتة ، ومنفصلة إلى جزيئات غازية فردية..
التجميد أو التصلب
تغيير حالة المادة السائلة إلى مادة صلبة عن طريق انخفاض درجة الحرارة. عندما يتم تبريد مادة سائلة ، تفقد جزيئاتها الكثير من الطاقة الحركية. عند الوصول إلى نقطة التجمد ، تتوقف الجزيئات عن الحركة وتهتز في وضع ثابت لتصبح جزيئات صلبة.
تسييل أو تكثيف
تغيير حالة المادة الغازية إلى سائل عن طريق انخفاض درجة الحرارة. عندما يتم تبريد مادة غازية ، تفقد جزيئاتها الكثير من الطاقة الحركية مما يجعلها تجتذب بعضها البعض لتصبح جزيئات سائلة.
تسامي
تتغير بعض المواد مباشرةً من حالتها الصلبة إلى حالتها الغازية أو العكس ، دون المرور بالحالة السائلة. عندما يتم تسخين هذه المواد الصلبة ، تتحرك جزيئاتها بسرعة بحيث تفصل بخارًا أو غازًا تمامًا ، والعكس بالعكس عندما تحدث العملية من مادة غازية إلى مادة صلبة.
مراجع
- دي Podesta ، M. فهم خصائص المسألة ، الطبعة الثانية. بريطانيا العظمى: تايلور وفرانسيس.
- جويل أ. نيودلهي: دار النشر ديسكفري.
- مور J ، ستانيتسكي C. العلوم الجزيئية ، الطبعة الخامسة. ستامفورد: Cengage التعلم.
- راماكريشنا أ. طبيعة المسألة ، الطبعة الأولى. نيودلهي: جويال براذرز براكاشان.
- Reger D، Goode S، Ball D. Chemistry. المبادئ والممارسة ، الطبعة الثالثة. كندا: بروكس / كول ، Cengage Learning.
- Shapere D. Matter (فيزياء). تم الاسترجاع من: accessscience.com.
- سينغ L ، Kaur M. المسألة في محيطنا. الهند: مدرسة S. Chand.


