الكربون في الطبيعة حيث تم العثور عليه وكيف ، والخصائص ، والاستخدامات
ال الكربون في الطبيعة يمكن العثور عليها في الماس والنفط والكتابات ، من بين العديد من السيناريوهات الأخرى. يحتل هذا العنصر الكيميائي المرتبة السادسة في الجدول الدوري ويقع في الصف أو الفترة الأفقية 2 والعمود 14. وهو غير معدني ورباعي التكافؤ ؛ وهذا يعني أنه يمكنك إنشاء 4 روابط كيميائية للإلكترونات المشتركة أو الروابط التساهمية.
الكربون هو العنصر الأكثر وفرة في قشرة الأرض. هذه الوفرة ، وتنوعها الفريد في تكوين المركبات العضوية وقدرتها الاستثنائية على تكوين جزيئات أو بوليمرات عند درجات الحرارة الشائعة على الأرض ، تجعلها بمثابة عنصر شائع في جميع أشكال الحياة المعروفة.

الكربون موجود في الطبيعة كعنصر كيميائي دون الجمع في أشكال الجرافيت والماس. ومع ذلك ، يتم دمجها في معظمها لتكوين مركبات كربون كيميائية ، مثل كربونات الكالسيوم (CaCO).3) وغيرها من المركبات في البترول والغاز الطبيعي.
كما أنها تشكل العديد من المعادن مثل أنثراسايت والفحم واللجنيت والجفت. أعظم أهمية للكربون هو أنه يشكّل ما يسمى "لبنة الحياة" وهو موجود في جميع الكائنات الحية.
مؤشر
- 1 أين يوجد الكربون وبأي شكل؟?
- 1.1 الأشكال الكريستال
- 1.2 أشكال غير متبلور
- 1.3 النفط والغاز الطبيعي والبيتومين
- 2 الخصائص الفيزيائية والكيميائية
- 2.1 الرمز الكيميائي
- 2.2 العدد الذري
- 2.3 الحالة المادية
- 2.4 اللون
- 2.5 الكتلة الذرية
- 2.6 نقطة انصهار
- 2.7 نقطة الغليان
- 2.8 الكثافة
- 2.9 الذوبان
- 2.10 التكوين الإلكتروني
- 2.11 عدد الإلكترونات في الطبقة الخارجية أو طبقة التكافؤ
- 2.12 سعة الرابط
- 2.13 Catenación
- 3 دورة الجيوكيميائية الحيوية
- 3.1 التمثيل الضوئي
- 3.2 التنفس والتحلل
- 3.3 العمليات الجيولوجية
- 3.4 تدخل النشاط البشري
- 4 الاستخدامات
- 4.1 النفط والغاز الطبيعي
- 4.2 الجرافيت
- 4.3 الماس
- 4.4 أنثراسايت
- 4.5 الفحم الصلب
- 4.6 Lignite
- 4.7 الخث
- 5 المراجع
حيث تم العثور على الكربون وبأي شكل?
بالإضافة إلى كونه العنصر الكيميائي المشترك لجميع أشكال الحياة ، والكربون في الطبيعة موجود في ثلاثة أشكال بلورية: الماس ، الجرافيت والفوليرين.
هناك أيضًا العديد من أشكال المعادن غير المتبلور من الفحم (أنثراسايت ولغنيت وفحم وخث) وأشكال سائلة (أنواع مختلفة من الزيوت) وصودا (غاز طبيعي).
الأشكال البلورية
في الأشكال البلورية ، تنضم ذرات الكربون لتشكيل أنماط مرتبة بترتيب مكاني هندسي.
الجرافيت
إنها مادة صلبة بلون أسود مع لمعان أو لمعان معدني ومقاومة للحرارة (مقاومة للحرارة). هيكلها البلوري يعرض ذرات الكربون المرتبطة بحلقات سداسية ، والتي بدورها تنضم معًا لتشكيل الصفائح.
رواسب الجرافيت نادرة وعثر عليها في الصين والهند والبرازيل وكوريا الشمالية وكندا.
الماس
إنها مادة صلبة للغاية وشفافة لمرور الضوء وأكثر كثافة بكثير من الجرافيت: قيمة كثافة الماس تعادل ضعف قيمة الجرافيت تقريبًا.
ذرات الكربون في الماس الانضمام في هندسة رباعي السطوح. وبالمثل ، يتكون الماس من الجرافيت الذي يتعرض لظروف درجات الحرارة والضغط المرتفعة جدًا (3000) °C و 100000 أجهزة الصراف الآلي).
وتقع معظم الماسات بين 140 و 190 كم في عمق الوشاح. من خلال الانفجارات البركانية العميقة ، تستطيع الصهارة نقلها إلى مسافات قريبة من السطح.
هناك حقول الماس في أفريقيا (ناميبيا وغانا وجمهورية الكونغو الديمقراطية وسيراليون وجنوب أفريقيا) وأمريكا (البرازيل وكولومبيا وفنزويلا وغيانا وبيرو) وأوقيانوسيا (أستراليا) وآسيا (الهند).

الفلورين
إنها أشكال جزيئية من الكربون تشكل مجموعات من 60 و 70 ذرة كربون في جزيئات كروية تقريبًا ، على غرار كرات كرة القدم.
هناك أيضا الفوليرين أصغر من 20 ذرة كربون. بعض أشكال الفوليرين تشمل أنابيب الكربون النانوية وألياف الكربون.

أشكال غير متبلور
في أشكال غير متبلورة ، لا تتحد ذرات الكربون ، وتشكل بنية بلورية منتظمة ومنتظمة. بدلاً من ذلك ، فإنها تحتوي على شوائب من عناصر أخرى.
فحم الإنتراسيت
إنه أقدم الفحم المعدني المتحول (والذي يأتي من تعديل الصخور بفعل درجة الحرارة أو الضغط أو الحركة الكيميائية للسوائل) ، حيث يرجع تاريخ تكوينه إلى العصر الأولي أو العصر الباليوزوي ، الفترة الكربونية.
أنثراسيت هو الشكل غير المتبلور للكربون الذي يحتوي على نسبة أعلى من هذا العنصر: بين 86 و 95 ٪. إنه لمعان رمادي-أسود ومعدني ، وهو ثقيل وصغير الحجم.
عمومًا ، يوجد أنثراسيت في مناطق تشوه جيولوجي ويشكل حوالي 1٪ من احتياطي الفحم في العالم.
توجد جغرافيا في كندا والولايات المتحدة الأمريكية وجنوب إفريقيا وفرنسا وبريطانيا العظمى وألمانيا وروسيا والصين وأستراليا وكولومبيا.

الفحم الصلب
إنه فحم معدني ، صخرة رسوبية من أصل عضوي ، ويعود تاريخ تكوينها إلى العصور القديمة والحضارية. يحتوي على نسبة الكربون بين 75 و 85 ٪.
لونه أسود ، يتميز بكونه غامقًا وله مظهر غير لامع ودهني ، حيث أنه يحتوي على نسبة عالية من المواد البيتومينية. يتم تشكيله عن طريق ضغط اللجنيت في العصر الباليوزوي ، في الفترات الكربونية والبرمي.
هذا هو الشكل الأكثر وفرة من الفحم على هذا الكوكب. هناك رواسب كبيرة للفحم في الولايات المتحدة وبريطانيا العظمى وألمانيا وروسيا والصين.
الفحم البني
هو الفحم المعدني الأحفوري الذي يتكون في العصر الثالث من الخث عن طريق الضغط (ضغوط عالية). يحتوي على نسبة أقل من الكربون من الفحم ، ما بين 70 و 80 ٪.
إنها مادة صغيرة مضغوطة ، متفتتة (مميزة تميزها عن معادن الكربون الأخرى) ، بنية أو سوداء. قوامه مشابه لنسيج الخشب ومحتواه من الكربون يتراوح بين 60 إلى 75٪.
إنه وقود سهل الاشتعال ، ذو قيمة منخفضة من السعرات الحرارية ومحتوى ماء أقل من الخث.
هناك مناجم اللجنيت المهمة في ألمانيا وروسيا وجمهورية التشيك وإيطاليا (مناطق فينيتو وتوسكاني وأومبريا) وسردينيا. توجد في إسبانيا رواسب اللجنيت في أستورياس وأندورا وسرقسطة ولا كورونيا.
الجفت
إنها مادة ذات أصل عضوي يتكون تكوينها من العصر الرباعي ، وهي أحدث بكثير من أنواع الفحم السابقة.
إنه لون بني-أصفر ويظهر ككتلة إسفنجية منخفضة الكثافة ، حيث يمكنك رؤية بقايا النباتات من المكان الذي نشأت فيه.
على عكس الفحم المذكور أعلاه ، فإن الخث لا يأتي من عمليات الكربنة للمواد الخشبية أو الخشب ، ولكن تم تشكيله من خلال تراكم النباتات - معظم الأعشاب والطحالب - في مناطق المستنقعات من خلال عملية الكربنة التي لم تكتمل..
الخث يحتوي على نسبة عالية من الماء. لهذا السبب فإنه يتطلب التجفيف والضغط قبل الاستخدام.
يحتوي على نسبة منخفضة من الكربون (55 ٪ فقط) ؛ لذلك ، لها قيمة طاقة منخفضة. عندما تتعرض للاحتراق ، فإن بقايا الرماد فيه وفيرة وتنبعث الكثير من الدخان.
توجد رواسب خث مهمة في تشيلي والأرجنتين (تييرا ديل فويغو) وإسبانيا (إسبينوزا دي سيراتو وبالينسيا) وألمانيا والدنمارك وهولندا وروسيا وفرنسا.

النفط والغاز الطبيعي والبيتومين
النفط (من اللاتينية بيتراي, مما يعني "الحجر" ؛ و أوليوم, الذي يعني "النفط": "زيت الصخور") هو مزيج من العديد من المركبات العضوية - معظم الهيدروكربونات - التي تنتجها التحلل البكتيري اللاهوائي (في حالة عدم وجود الأكسجين) من المواد العضوية.
تشكلت في باطن الأرض ، في أعماق كبيرة وتحت ظروف خاصة ، سواء الفيزيائية (الضغوط العالية ودرجات الحرارة) والكيميائية (وجود مركبات محفز محددة) في عملية استغرقت ملايين السنين.
خلال هذه العملية ، تم إطلاق C و H من الأنسجة العضوية وانضمت إلى إعادة التركيب مرة أخرى ، لتشكيل عدد كبير من الهيدروكربونات التي يتم خلطها وفقًا لخصائصها ، وتشكيل الغاز الطبيعي والزيت والبيتومين.
تقع حقول النفط في الكوكب بشكل رئيسي في فنزويلا والمملكة العربية السعودية والعراق وإيران والكويت والإمارات العربية المتحدة وروسيا وليبيا ونيجيريا وكندا..
هناك احتياطيات من الغاز الطبيعي في روسيا وإيران وفنزويلا وقطر والولايات المتحدة والمملكة العربية السعودية والإمارات العربية المتحدة وغيرها.
الخصائص الفيزيائية والكيميائية
من بين خصائص الكربون يمكننا ذكر ما يلي:
الرمز الكيميائي
C.
الرقم الذري
6.
الحالة المادية
صلبة ، في ظل الظروف العادية للضغط ودرجة الحرارة (1 الغلاف الجوي و 25 °C).
اللون
الرمادي (الجرافيت) وشفافة (الماس).
الكتلة الذرية
12،011 جم / مول.
نقطة انصهار
500 °C.
نقطة الغليان
827 °C.
كثافة
2.62 جم / سم3.
الذوبانية
غير قابل للذوبان في الماء ، قابل للذوبان في رابع كلوريد الكربون CCl4.
التكوين الإلكتروني
1S2 2S2 2P2.
عدد الإلكترونات في الطبقة الخارجية أو التكافؤ
4.
سعة الرابط
4.
السلسال
لديها القدرة على تكوين مركبات كيميائية في سلاسل طويلة.
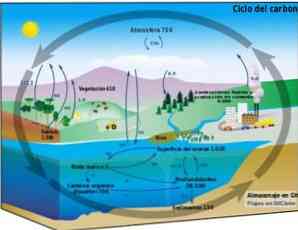
دورة الكيمياء الحيوية
دورة الكربون عبارة عن عملية كيميائية حيوية دائرية يمكن من خلالها تبادل الكربون بين المحيط الحيوي والغلاف الجوي والغلاف المائي والغلاف الصخري الأرضي.
تتيح معرفة عملية الكربون الحلقية هذه على الأرض إثبات فعل الإنسان في هذه الدورة وعواقبها على تغير المناخ العالمي.
يمكن أن ينتشر الكربون بين المحيطات وغيرها من المسطحات المائية ، وكذلك بين الغلاف الصخري ، في التربة وتربة التربة ، وفي الغلاف الجوي والمحيط الحيوي. في الغلاف الجوي والغلاف المائي ، يوجد الكربون في صورة غازية مثل ثاني أكسيد الكربون2 (ثاني أكسيد الكربون).
التركيب الضوئي
يتم التقاط الكربون الموجود في الغلاف الجوي بواسطة الكائنات البرية والمائية للنظم الإيكولوجية (الكائنات العضوية الضوئية).
يسمح التركيب الضوئي بإجراء تفاعل كيميائي بين ثاني أكسيد الكربون2 والماء ، بوساطة الطاقة الشمسية والكلوروفيل من النباتات ، لإنتاج الكربوهيدرات أو السكريات. هذه العملية تحول جزيئات بسيطة مع انخفاض محتوى الطاقة CO2, H2O والأكسجين O2, في أشكال جزيئية معقدة من الطاقة العالية ، والتي هي السكريات.
تحصل الكائنات غير المتجانسة - التي لا تستطيع القيام بعملية التمثيل الضوئي والتي هي المستهلك في النظم البيئية - على الكربون والطاقة عند إطعام نفسها للمنتجين والمستهلكين الآخرين.
التنفس والتحلل
التنفس والتحلل هما عمليتان بيولوجيتان تطلقان الكربون إلى البيئة في شكل ثاني أكسيد الكربون2 أو CH4 (الميثان الناتج في التحلل اللاهوائي ، أي في غياب الأكسجين).
العمليات الجيولوجية
من خلال العمليات الجيولوجية ونتيجة لمرور الوقت ، يمكن تحويل الكربون من التحلل اللاهوائي إلى أنواع الوقود الأحفوري مثل النفط والغاز الطبيعي والفحم. وبالمثل ، يعد الكربون أيضًا جزءًا من المعادن والصخور الأخرى.
تدخل النشاط البشري
عندما يستخدم الإنسان حرق الوقود الأحفوري للحصول على الطاقة ، يعود الكربون إلى الغلاف الجوي في شكل كميات هائلة من ثاني أكسيد الكربون2 لا يمكن استيعابها من خلال دورة الكيمياء الحيوية الطبيعية للكربون.
هذا الفائض CO2 ينتج عن النشاط البشري تأثير سلبي على توازن دورة الكربون وهو السبب الرئيسي للاحتباس الحراري.
تطبيقات
استخدامات الكربون ومركباته متنوعة للغاية. الأكثر تميزا مع ما يلي:
النفط والغاز الطبيعي
يتمثل الاستخدام الاقتصادي الرئيسي للكربون في استخدامه كهروكربونات وقود أحفوري ، مثل غاز الميثان والبترول..
يتم تقطير النفط في المصافي للحصول على مشتقات متعددة مثل البنزين والديزل والكيروسين والإسفلت ومواد التشحيم والمذيبات وغيرها ، والتي بدورها تستخدم في صناعة البتروكيماويات التي تنتج المواد الخام لصناعة البلاستيك والأسمدة والأدوية والدهانات. ، من بين أمور أخرى.
الجرافيت
يستخدم الجرافيت في الإجراءات التالية:
- يتم استخدامه في صناعة أقلام الرصاص الممزوجة بالطين.
- إنها جزء من صناعة الطوب المقاوم للحرارة والبوتقات المقاومة للحرارة.
- في الأجهزة الميكانيكية المختلفة مثل الغسالات والمحامل والمكابس والحشيات.
- وهو زيوت التشحيم الصلبة ممتازة.
- بسبب التوصيلية الكهربائية وخمولها الكيميائي ، يتم استخدامه في صناعة الأقطاب الكهربائية ، الفحم الحجري الكهربائي.
- يتم استخدامه كمشرف في محطات الطاقة النووية.
الماس
الماس له خصائص فيزيائية استثنائية بشكل خاص ، مثل درجة الصلابة العالية والتوصيل الحراري المعروفة حتى الآن.
تسمح هذه الميزات للتطبيقات الصناعية في الأدوات المستخدمة في إجراء عمليات القطع وأدوات التلميع من أجل كشطها العالي.
خصائصه الضوئية - مثل الشفافية والقدرة على تحطيم الضوء الأبيض وانكسار الضوء - تعطيه العديد من التطبيقات في الأجهزة البصرية ، كما هو الحال في صناعة العدسات والمنشورات.
هو أيضا موضع تقدير سطوع مميزة المستمدة من خصائصه البصرية في صناعة المجوهرات.
فحم الإنتراسيت
أنثراسايت لديه صعوبة في الإشعال ، وحرق بطيء ويتطلب الكثير من الأكسجين. ينتج عن الاحتراق القليل من اللهب ذي اللون الأزرق الشاحب وانبعاث الكثير من الحرارة.
منذ بضع سنوات ، كان يستخدم أنثراسايت في مصانع الطاقة الحرارية والتدفئة المنزلية. يتميز استخدامه بمزايا مثل إنتاج القليل من الرماد أو الغبار والدخان القليل وعملية الاحتراق البطيء.
بسبب التكلفة الاقتصادية العالية والندرة ، تم استبدال أنثراسايت بالغاز الطبيعي في محطات الطاقة الحرارية والطاقة الكهربائية في المنازل.
الفحم الصلب
يستخدم الفحم كمواد خام للحصول على:
- فحم الكوك ، وقود من أفران الصهر في مصانع الصلب.
- كريوسوت ، التي تم الحصول عليها عن طريق خلط القطران نواتج التقطير من الفحم الصلب واستخدامها كمادة مانعة للتسرب للخشب يتعرض للطقس.
- كريسول (ميثيل فينول كيميائيًا) المستخلص من الفحم ويستخدم كمطهر ومطهر,
- مشتقات أخرى مثل الغاز أو القطران أو المركبات ، والمركبات المستخدمة في صناعة العطور والمبيدات الحشرية والبلاستيك والدهانات والإطارات وأرصفة الطرق ، وغيرها..
الفحم البني
Lignite يمثل وقود ذات جودة متوسطة. تتميز الطائرة ، المتنوعة من اللجنيت ، بكونها مضغوطة للغاية من خلال عملية الكربنة الطويلة والضغوط العالية ، وتستخدم في المجوهرات والزخرفة.
الجفت
يستخدم الخث في الأنشطة التالية ؛
- لنمو ودعم ونقل الأنواع النباتية.
- كسماد عضوي.
- كسرير للحيوانات في الاسطبلات.
- كوقود منخفض الجودة.
مراجع
- Burrows، A.، Holman، J.، Parsons، A.، Pilling، G. and Price، G. (2017). الكيمياء 3: إدخال الكيمياء غير العضوية والعضوية والفيزيائية. مطبعة جامعة أكسفورد.
- ديمنج ، أ. (2010). ملك العناصر؟ تكنولوجيا النانو. 21 (30): 300201. دوي: 10.1088
- Dienwiebel، M.، Verhoeven، G.، Pradeep، N.، Frenken، J.، Heimberg، J. and Zandbergen، H. (2004). Superlubricity من الجرافيت. خطابات المراجعة البدنية. 92 (12): 126101. doi: 10.1103
- Irifune، T.، Kurio، A.، Sakamoto، S.، Inoue، T. and Sumiya، H. (2003). المواد: الماس متعدد الصلابة من الجرافيت. الطبيعة. 421 (6923): 599-600. دوي: 10.1038
- Savvatimskiy، A. (2005). قياسات نقطة انصهار الجرافيت وخصائص الكربون السائل (مراجعة 1963-2003). الكربون. 43 (6): 1115. دوي: 10.1016


