أنواع الكيتونات ، الخصائص ، التسميات ، الاستخدامات والأمثلة
ال الكيتونات هي مركبات عضوية تمتلك مجموعة كربونية (-CO). وهي مركبات بسيطة يتم فيها ربط الكربون الموجود في مجموعة الكربونيل بذرتين من الكربون (وسلاسلهما البديلة). الكيتونات "بسيطة" لأنها لا تحتوي على مجموعات تفاعلية مثل -OH أو -Cl متصلة بالكربون.
أخيرًا ، عادة ما يرتبط التخلص من الكيتونات من جسم الإنسان بمستوى منخفض من السكر (في حالات السكري و / أو الصيام الشديد) ، مما قد يسبب مشاكل صحية خطيرة للمريض.
مؤشر
- 1 الصيغة العامة للكيتونات
- 2 أنواع الكيتونات
- 2.1 وفقا لهيكل سلسلة الخاص بك
- 2.2 حسب تناظر جذوره
- 2.3 حسب تشبع جذوره
- 2.4 ديكتونس
- 3 الخصائص الفيزيائية والكيميائية للكيتونات
- 3.1 نقطة الغليان
- 3.2 الذوبان
- 3.3 الحموضة
- 3.4 التفاعل
- 4 التسمية
- 5 الفرق بين الألدهيدات والكيتونات
- 6 يستخدم الصناعية والحياة اليومية
- 7 أمثلة للكيتونات
- 7.1 بوتانون (C4H8O)
- 7.2 السيكلوهكسانون (C6H10O)
- 7.3 التيستوستيرون (C19H22O2)
- 7.4 البروجسترون (C21H30O2)
- 8 المراجع
الصيغة العامة للكيتونات
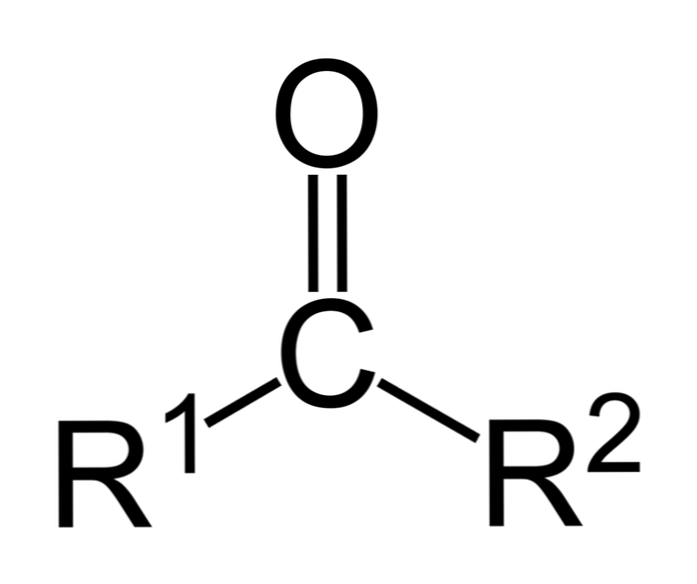
الكيتونات هي مركبات كربونية ترتبط فيها هذه المجموعة بمجموعتين من المواد الهيدروكربونية ؛ قد تكون هذه مجموعات ألكيل أو مجموعات حلقات بنزين أو كليهما.
يمكن ببساطة تمثيل الكيتون على أنه R- (C = O) -R '، حيث يمثل R و R' أي سلسلتين هيدروكربونية (الألكانات ، الألكينات ، الألكينات ، السيكلوكلانات ، مشتقات البنزين وغيرها). لا توجد الكيتونات مع الهيدروجين تعلق على مجموعة الكربونيل.
هناك مجموعة واسعة من الطرق لإعداد الكيتونات في البيئة الصناعية والمخبرية ؛ بالإضافة إلى ذلك ، من المهم ملاحظة أنه يمكن تصنيع الكيتونات بواسطة كائنات مختلفة ، بما في ذلك البشر.
في الصناعة ، تشتمل الطريقة الأكثر شيوعًا لتخليق الكيتونات على أكسدة الهيدروكربونات ، عادة باستخدام الهواء. على نطاق صغير ، عادة ما يتم إعداد الكيتونات من خلال أكسدة الكحول الثانوية ، والتي تعطي كمنتج كيتون وماء..
إلى جانب هذه الطرق الأكثر شيوعًا ، يمكن تصنيع الكيتونات من خلال الألكينات والألكينات وأملاح مركبات النيتروجين والإسترات والعديد من المركبات الأخرى ، مما يسهل الحصول عليها.
أنواع الكيتونات
هناك عدة تصنيفات للكيتونات ، تعتمد بشكل رئيسي على البدائل في سلاسلها R. فيما يلي التصنيفات الأكثر شيوعًا لهذه المواد:
وفقا لهيكل سلسلة الخاص بك
في هذه الحالة ، يتم تصنيف الكيتون من خلال الطريقة التي يتم بها تنظيم سلسلته: الكيتونات الأليفاتية هي تلك التي لها جذري R و R 'لهما شكل جذر ألكيل (ألكانات ، ألكينات ، ألكينات ، أريكينات وأركان حلقية).
من جانبها ، العطريات هي تلك التي تشكل مشتقات البنزين ، في حين لا تزال الكيتونات. أخيرًا ، الكيتونات المختلطة هي تلك التي لها جذري ألكيل وجذر أريل ، أو بالعكس.
حسب تناظر جذوره
في هذه الحالة ، تتم دراسة بدائل R و R من مجموعة الكاربونيل. عندما تكون هذه متساوية (متطابقة) يُطلق على الكيتون التناظر ؛ ولكن عندما تكون مختلفة (مثل معظم الكيتونات) ، وهذا ما يسمى غير المتماثلة.
حسب تشبع جذوره
يمكن تصنيف الكيتونات أيضًا وفقًا لتشبع سلاسل الكربون الخاصة بها ؛ إذا كانت هذه في شكل ألكانات ، فإن الكيتون يسمى الكيتون المشبع. في المقابل ، إذا تم العثور على السلاسل كألكينات أو ألكينات ، فإن الكيتون يسمى الكيتون غير المشبع.
diketones
هذه فئة منفصلة من الكيتون ، لأن سلاسل هذه الكيتون لها مجموعتان من الكربونييل في بنيتها. تتميز بعض هذه الكيتونات بخصائص فريدة ، مثل طول الرابطة الأطول بين الكربون.
على سبيل المثال ، تُعرف الديكتون المستمدة من السيكلوهكسان باسم الكينون ، وهما فقط: أرثو بينزوكينون وشبه البنزكوينون.
الخصائص الفيزيائية والكيميائية للكيتونات
الكيتونات ، مثل معظم الألدهيدات ، هي جزيئات سائلة ولها سلسلة من الخصائص الفيزيائية والكيميائية التي تختلف تبعا لطول سلاسلها. خصائصه موصوفة أدناه:
نقطة الغليان
الكيتونات شديدة التقلب وذات قطبية عالية ولا يمكنها التبرع بالهيدروجين لسندات الهيدروجين (لا تمتلك ذرات هيدروجين مرتبطة بمجموعة الكاربونيل الخاصة بها) ، وبالتالي فهي تتمتع بنقاط غليان أعلى من الألكينات والإيثرات ، ولكنها أقل من تلك الكحول من نفس الوزن الجزيئي.
تزداد نقطة غليان الكيتون مع زيادة حجم الجزيء. ويرجع ذلك إلى تدخل قوات فان دير فالس وقوات ثنائي القطب ثنائي القطب ، والتي تتطلب قدرًا أكبر من الطاقة لفصل الذرات والإلكترونات المنجذبة إلى الجزيء..
الذوبانية
إن قابلية ذوبان الكيتونات لها تأثير قوي جزئياً على قدرة هذه الجزيئات على قبول الهيدروجين في ذرة الأكسجين وبالتالي تكوين رابطة هيدروجينية بالماء. بالإضافة إلى ذلك ، يتم تشكيل قوى جذابة ومبعثرة وثنائيات أقطاب ثنائية القطب بين الكيتونات والمياه ، مما يزيد من تأثيرها القابل للذوبان.
تفقد الكيتونات قدرة الذوبان كلما زاد جزيئها ، لأنها تبدأ في طلب المزيد من الطاقة للذوبان في الماء. كما أنها قابلة للذوبان في المركبات العضوية.
خميرة
بفضل مجموعة الكاربونيل ، تتمتع الكيتونات بطبيعتها الحمضية. يحدث هذا بسبب قدرة تثبيت الرنين لهذه المجموعة الوظيفية ، والتي يمكنها نقل البروتونات من الرابطة المزدوجة لتشكيل قاعدة مترابطة تسمى enol.
التفاعلية
الكيتونات هي جزء من عدد كبير من التفاعلات العضوية. يحدث هذا بسبب قابلية الكربون الكربوني له للإضافة النواة ، بالإضافة إلى قطبية هذا.
كما هو مذكور أعلاه ، فإن التفاعل العالي للكيتونات يجعلها منتجًا متوسطًا معترفًا به يعمل كأساس لتوليف المركبات الأخرى.
تسمية
تتم تسمية الكيتونات وفقًا لأولوية أو أهمية مجموعة الكاربونيل في الجزيء بأكمله ، لذلك عندما يكون لديك جزيء تحكمه مجموعة الكاربونيل ، يتم تسمية الكيتون بإضافة اللاحقة "-one" إلى اسم الهيدروكربون.
تعتبر السلسلة الأطول مع مجموعة الكاربونيل هي السلسلة الرئيسية ، ثم يتم تسمية الجزيء. إذا كانت مجموعة الكاربونيل ليست لها الأولوية على المجموعات الوظيفية الأخرى للجزيء ، فسيتم تعريفها بـ "-oxo".
بالنسبة إلى الكيتونات الأكثر تعقيدًا ، يمكن تحديد موضع المجموعة الوظيفية برقم ، وفي حالة الديكتونات (الكيتونات ذات البديلين المتماثلين R و R) ، يتم تسمية الجزيء ذو اللاحقة "-dione"..
أخيرًا ، يمكن أيضًا استخدام كلمة "ketone" بعد تحديد سلاسل الجذور المرتبطة بالمجموعة الوظيفية للكربونيل.
الفرق بين الألدهيدات والكيتونات
الفرق الأكبر بين الألدهيدات والكيتونات هو وجود ذرة هيدروجين متصلة بمجموعة الكاربونيل في الألدهيدات..
هذه الذرة لها تأثير مهم عندما يتعلق الأمر بإشراك جزيء في تفاعل الأكسدة: سوف يشكل الألدهيد حمض الكربوكسيل أو ملح حمض الكربوكسيل ، وهذا يتوقف على ما إذا كان الأكسدة يحدث في ظل الظروف الحمضية أم الأساسية.
في المقابل ، لا يحتوي الكيتون على هذا الهيدروجين ، لذلك لا تحدث الخطوات الدنيا اللازمة للأكسدة.
هناك طرق لأكسدة الكيتون (مع عوامل مؤكسدة أقوى بكثير من تلك المستخدمة عادة) ، ولكن هذه تكسر جزيء الكيتون ، وتقسيمه أولاً إلى جزأين أو أكثر.
يستخدم الحياة الصناعية واليومية
غالبًا ما يتم ملاحظة الكيتونات في صناعة العطور والدهانات ، حيث تقوم بأدوار مثبتات ومواد حافظة تمنع المكونات الأخرى من الخليط من التدهور ؛ لديهم أيضا مجموعة واسعة من المذيبات في تلك الصناعات التي تصنع المتفجرات والدهانات والمنسوجات ، بالإضافة إلى المستحضرات الصيدلانية.
الأسيتون (أصغر وأبسط الكيتون) هو مذيب معترف به في جميع أنحاء العالم ، ويستخدم كمزيل للطلاء وأرق.
في الطبيعة ، يمكن أن تظهر الكيتونات على أنها سكريات تسمى الكيتوز. الكيتوز هي السكريات الأحادية التي تحتوي على كيتون واحد لكل جزيء. الكيتوز الأكثر شهرة هو الفركتوز ، السكر الموجود في الفواكه والعسل.
كما يحدث التخليق الحيوي للأحماض الدهنية الذي يحدث داخل السيتوبلازم في الخلايا الحيوانية من خلال عمل الكيتونات. أخيرًا ، وكما ذكر أعلاه ، قد يكون هناك ارتفاع في الكيتونات في الدم بعد الصيام أو في حالات السكري.
أمثلة على الكيتونات
بوتانون (C4H8O)
المعروف أيضًا باسم MEK (أو MEC) ، ويتم إنتاج هذا السائل على نطاق واسع في الصناعة ويستخدم كمذيب.
السيكلوهكسانون6H10O)
يتم إنتاج هذا الكيتون على نطاق واسع ، وهو مادة مسبقة لمواد النايلون الاصطناعية.
التستوستيرون (جيم19H22O2)
وهو الهرمون الرئيسي للجنس الذكوري والستيرويد المنشطة ، الموجود في معظم الفقاريات.
البروجسترون21H30O2)
الستيرويد الداخلي وهرمون الجنس المتورطين في الدورة الشهرية والحمل والجنين عند البشر والأنواع الأخرى.
مراجع
- ويكيبيديا. (بدون تاريخ). كيتون. تم الاسترجاع من en.wikipedia.org
- Britannica، E. (s.f.). كيتون. تم الاسترجاع من britannica.com
- الجامعة ، م. س. الألدهيدات والكيتونات. تم الاسترجاع من chemistry.msu.edu
- ChemGuide. (بدون تاريخ). تقديم الألدهيدات والكيتونات. تم الاسترجاع من chemguide.co.uk
- كالجاري ، U. O. (s.f.). الكيتونات. تم الاسترجاع من chem.ucalgary.ca


