هيكل الإيثان وخصائصه واستخداماته ومخاطره
ال الإيثان هو هيدروكربون بسيط من الصيغة C2H6 مع طبيعة الغاز عديم اللون والرائحة التي لها قيمة كبيرة ومتنوعة الاستخدام في تخليق الإيثيلين. بالإضافة إلى ذلك ، إنه أحد الغازات الأرضية التي تم اكتشافها أيضًا في كواكب أخرى وأجسام نجوم حول النظام الشمسي. اكتشفه العالم مايكل فاراداي في عام 1834.
من بين العدد الكبير من المركبات العضوية المتكونة من ذرات الكربون والهيدروجين (المعروفة باسم الهيدروكربونات) ، هناك تلك الموجودة في حالة غازية في درجات الحرارة والضغوط البيئية ، والتي تستخدم بشكل كبير في العديد من الصناعات.
وعادة ما تأتي من خليط غازي يسمى "الغاز الطبيعي" ، وهو منتج ذو قيمة عالية للبشرية ، ويشكل الميثان من نوع الميثان والإيثان والبروبان والبيوتان ، من بين أشياء أخرى ؛ تصنف وفقا لكمية من ذرات الكربون في سلسلة لها.
مؤشر
- 1 التركيب الكيميائي
- 1.1 توليف الإيثان
- 2 خصائص
- 2.1 ذوبان الإيثان
- 2.2 تبلور الإيثان
- 2.3 احتراق الإيثان
- 2.4 الإيثان في الجو وفي الأجرام السماوية
- 3 الاستخدامات
- 3.1 انتاج الاثيلين
- 3.2 تدريب المواد الكيميائية الأساسية
- 3.3 المبردات
- 4 مخاطر الايثان
- 5 المراجع
التركيب الكيميائي
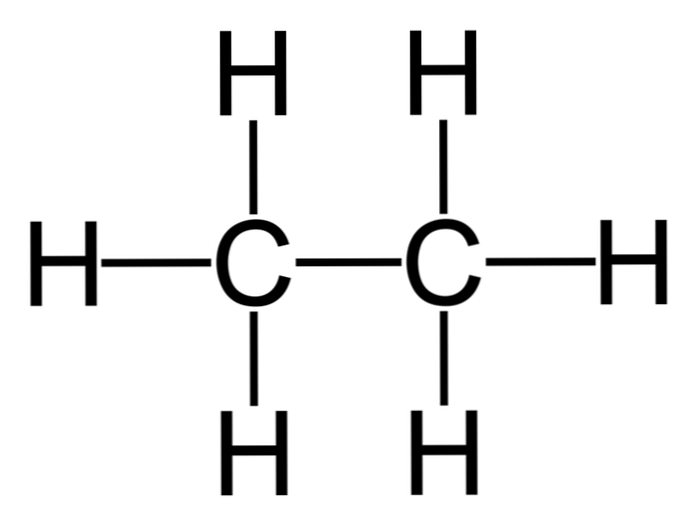
الإيثان هو جزيء له الصيغة C2H6, عادة ما ينظر إليه على أنه اتحاد لمجموعتين من الميثيل3) لتشكيل الهيدروكربونات من رابطة الكربون الكربون بسيطة. وهو أيضًا أبسط مركب عضوي بعد الميثان ، ويمثل على النحو التالي:
H3C-CH3
تمتلك ذرات الكربون في هذا الجزيء التهجين sp3, وبالتالي فإن الروابط الجزيئية تقدم دوران حر.
أيضا ، هناك ظاهرة جوهرية للإيثان ، والتي تقوم على دوران الهيكل الجزيئي لنفسه والحد الأدنى من الطاقة اللازمة لإنتاج دوران الرابطة 360 درجة ، والتي يطلق عليها العلماء "حاجز الإيثان".
لهذا السبب ، يمكن أن يحدث الإيثان في تكوينات مختلفة وفقًا لتدويره ، على الرغم من وجود تشوه أكثر ثباتًا عندما تكون الهيدروجين معاكسة لبعضها البعض (كما هو موضح في الشكل).

توليف الايثان
يمكن تصنيع الإيثان بسهولة من التحليل الكهربائي لـ Kolbe ، وهو تفاعل عضوي تحدث فيه خطوتان: إزالة الكربوكسيل الكهروكيميائي (إزالة مجموعة الكربوكسيل وإطلاق ثاني أكسيد الكربون) من اثنين من الأحماض الكربوكسيلية ، ومزيج من المنتجات يتوسط لتشكيل رابطة تساهمية.
وبالمثل ، يؤدي التحليل الكهربائي لحمض الخليك إلى تكوين الإيثان وثاني أكسيد الكربون ، ويستخدم هذا التفاعل لتوليف الأول.
أكسدة أنهيدريد الخل بواسطة عمل البيروكسيدات ، وهو مفهوم مشابه لمفهوم التحليل الكهربي لكولبي ، يؤدي أيضًا إلى تكوين الإيثان.
بالطريقة نفسها ، يمكن فصله بكفاءة عن الغاز الطبيعي والميثان من خلال عملية تسييل ، باستخدام أنظمة التجميد لالتقاط هذا الغاز وفصله عن الخلائط مع غازات أخرى..
تفضل عملية التمدد التوربيني لهذا الدور: يتم تمرير خليط الغاز عبر التوربينات ، مما يولد تمددًا ، حتى تنخفض درجة حرارته إلى أقل من -100 درجة مئوية.
بالفعل في هذه المرحلة ، يمكن التمييز بين مكونات الخليط ، بحيث يتم فصل الإيثان السائل عن الميثان الغازي والنوع الآخر المتورط باستخدام التقطير.
خصائص
يحدث الإيثان في الطبيعة كغاز عديم الرائحة وعديم اللون في ضغوط ودرجات حرارة قياسية (1 atm و 25 درجة مئوية). لديها نقطة غليان -88.5 درجة مئوية ، ونقطة انصهار -182.8 درجة مئوية. بالإضافة إلى ذلك ، لا يتأثر بالتعرض لأحماض أو قواعد قوية.
ذوبان الايثانول
جزيئات الإيثان لها تكوين متماثل ولديها قوى جذب ضعيفة تجعلها متماسكة ، تسمى قوى التشتت.
عندما يتم محاولة إذابة الإيثان في الماء ، تكون قوى الجذب التي تشكلت بين الغاز والسائل ضعيفة للغاية ، بحيث يكون من الصعب للغاية ربط الإيثان بجزيئات الماء..
لهذا السبب ، تكون قابلية ذوبان الإيثان منخفضة بدرجة كبيرة ، حيث تزيد قليلاً عندما يرتفع ضغط النظام.
تبلور الإيثان
يمكن ترسيخ الإيثان ، مما يؤدي إلى تكوين بلورات إيثان غير مستقرة ذات بنية بلورية مكعبة.
مع انخفاض درجة الحرارة إلى ما دون -183.2 درجة مئوية ، يصبح هذا الهيكل أحادي الميل ، مما يزيد من ثبات جزيئه.
الإيثان الاحتراق
هذا الهيدروكربون ، على الرغم من أنه لا يستخدم على نطاق واسع كوقود ، يمكن استخدامه في عمليات الاحتراق لتوليد ثاني أكسيد الكربون والماء والحرارة ، والذي يتم تمثيله على النحو التالي:
2C2H6 + 7O2 → 4CO2 + 6H2O + 3120 kJ
هناك أيضًا إمكانية لحرق هذا الجزيء بدون زيادة في الأكسجين ، والذي يُعرف باسم "الاحتراق غير الكامل" ، والذي ينتج عنه تكوين الكربون غير المتبلور وأول أكسيد الكربون في تفاعل غير مرغوب فيه ، اعتمادًا على كمية الأكسجين المطبق :
2C2H6 + 3O2 → 4C + 6H2يا + الحرارة
2C2H6 + 4O2 → 2C + 2CO + 6H2يا + الحرارة
2C2H6 + 5O2 → 4CO + 6H2يا + الحرارة
في هذا المجال ، يحدث الاحتراق من خلال سلسلة من ردود الفعل الجذرية الحرة ، والتي يتم ترقيمها في مئات ردود الفعل المختلفة. على سبيل المثال ، يمكن تشكيل مركبات مثل الفورمالديهايد ، الأسيتالديهيد ، الميثان ، الميثانول والإيثانول في تفاعلات الاحتراق غير الكاملة..
يعتمد هذا على الظروف التي يحدث فيها رد الفعل وردود الفعل الحرة الجذرية المعنية. يمكن أيضًا تشكيل الإثيلين في درجات حرارة عالية (600-900 درجة مئوية) ، وهو منتج مرغوب فيه للغاية من قبل الصناعة.
الإيثان في الغلاف الجوي والأجرام السماوية
يتواجد الإيثان في جو الكوكب الأرضي في آثار ، ويشتبه في أن الإنسان قد تمكن من مضاعفة هذا التركيز منذ أن بدأ ممارسة الأنشطة الصناعية.
يعتقد العلماء أن الكثير من الوجود الحالي للإيثان في الغلاف الجوي يرجع إلى احتراق الوقود الأحفوري ، على الرغم من أن الانبعاثات العالمية من الإيثان انخفضت بمقدار النصف تقريبًا منذ تحسين تقنيات إنتاج الغاز الصخري (أ) مصدر الغاز الطبيعي).
كما يتم إنتاج هذا النوع بشكل طبيعي عن طريق تأثير الأشعة الشمسية على الميثان في الغلاف الجوي ، والذي يعيد تجميع ويشكل جزيء الإيثان.
الإيثان موجود في حالة سائلة على سطح تيتان ، أحد أقمار زحل. يحدث هذا بكمية أكبر في نهر فيد فلومينا ، الذي يتدفق لأكثر من 400 كيلومتر باتجاه أحد بحارها. كما تم إثبات هذا المركب على المذنبات ، وعلى سطح بلوتو.
تطبيقات
انتاج الاثيلين
يعتمد استخدام الإيثان أساسًا على إنتاج الإيثيلين ، المنتج العضوي الأكثر استخدامًا في الإنتاج العالمي ، من خلال عملية تعرف باسم تكسير البخار..
تتكون هذه العملية من نقل تغذية الإيثان المخفف بالبخار إلى فرن ، وتسخينه بسرعة دون أكسجين.
يحدث التفاعل عند درجة حرارة مرتفعة للغاية (بين 850 و 900 درجة مئوية) ، ولكن يجب أن يكون وقت الإقامة (الوقت الذي يقضيه الإيثان داخل الفرن) قصيرًا حتى يكون التفاعل فعالاً. عند ارتفاع درجات الحرارة ، يتم توليد المزيد من الإيثيلين.
تدريب المواد الكيميائية الأساسية
كما تم دراسة الإيثان كعنصر رئيسي في تكوين المواد الكيميائية الأساسية. الكلورة المؤكسدة هي واحدة من العمليات المقترحة للحصول على كلوريد الفينيل (مكون من PVC) ، لتحل محل أقل تكلفة وأكثر تعقيدا.
مبرد
أخيرًا ، يتم استخدام الإيثان كمبرد في الأنظمة المبردة الشائعة ، مما يُظهر أيضًا القدرة على تجميد العينات الصغيرة في المختبر للتحليل.
إنه بديل جيد جدًا للمياه ، والذي يستغرق وقتًا أطول لتبريد العينات الحساسة ، ويمكن أن يولد أيضًا تكوين بلورات ثلجية ضارة.
مخاطر الإيثان
-الإيثان لديه القدرة على الاشتعال ، خاصة عندما يرتبط بالهواء. عند نسبة تتراوح بين 3.0 و 12.5٪ من حجم الإيثان في الهواء ، قد يتشكل خليط متفجر.
-يمكن أن تحد من الأكسجين الموجود في الهواء الذي تم العثور عليه ، ولهذا السبب يمثل عامل خطر الاختناق للأشخاص والحيوانات الموجودة والمعرضة.
-الإيثان في شكل سائل متجمد يمكن أن يحرق الجلد بشدة إذا ما تلامس بشكل مباشر معه ، ويعمل أيضًا كوسيط مبرد لأي جسم يلمسه ، ويجمده في لحظات.
-أبخرة الإيثان السائل أثقل من الهواء وتتركز على الأرض ، مما قد يؤدي إلى خطر الاشتعال الذي يمكن أن يولد تفاعل احتراق متسلسل.
-تناول الإيثان يمكن أن يسبب الغثيان والقيء والنزيف الداخلي. الاستنشاق ، بالإضافة إلى الاختناق ، يسبب الصداع والارتباك وتقلب المزاج. الموت بسبب السكتة القلبية ممكن في حالات التعرض العالية.
-إنه يمثل غازات الدفيئة التي تسهم ، إلى جانب الميثان وثاني أكسيد الكربون ، في الاحترار العالمي وتغير المناخ الناتج عن التلوث البشري. لحسن الحظ ، فهو أقل وفرة من الميثان ، ويمتص إشعاعات أقل من هذا.
مراجع
- Britannica، E. (s.f.). الإيثان. تم الاسترجاع من britannica.com
- Nes، G. V. (s.f.). هياكل أحادية البلورة وتوزيعات كثافة الإلكترون للإيثان والإيثيلين والأسيتيلين. تعافى من rug.nl
- المواقع ، ج. الإيثان: المصادر والمصارف. تم الاسترجاع من sites.google.com
- SoftSchools. (بدون تاريخ). الايثان الفورمولا. تعافى من softschools.com
- ويكيبيديا. (بدون تاريخ). الإيثان. تم الاسترجاع من en.wikipedia.org


