أنواع الهندسة الجزيئية والأمثلة
ال الهندسة الجزيئية أو التركيب الجزيئي هو التوزيع المكاني للذرات حول الذرة المركزية. تمثل الذرات مناطق ذات كثافة إلكترونية عالية ، وبالتالي فهي تعتبر مجموعات إلكترونية ، بغض النظر عن الروابط التي تشكل (مفردة أو مزدوجة أو ثلاثية).
وُلد هذا المفهوم من مجموعة من البيانات النظرية والتجريبية لنظريتين: تلك الخاصة بترابط التكافؤ (TEV) وصد الأزواج الإلكترونية لقذيفة التكافؤ (VSPR). في حين أن الأولى تحدد الروابط وزواياها ، فإن الثانية تحدد الهندسة ، وبالتالي ، التركيب الجزيئي.

ما هي الأشكال الهندسية الجزيئات القادرة على تبنيها؟ توفر النظريتان السابقتان الإجابات. وفقًا لـ VSEPR ، يجب ترتيب ذرات وأزواج الإلكترونات الحرة في الفضاء بطريقة تقلل من التنافر الكهروستاتيكي بينهما..
لذلك ، الأشكال الهندسية ليست تعسفية ، ولكن ابحث عن التصميم الأكثر ثباتًا. على سبيل المثال ، في الصورة العلوية ، يمكن رؤية مثلث على اليسار ، ثم مثمن على اليمين. تمثل النقاط الخضراء الذرات والشرائط البرتقالية الروابط.
في المثلث ، يتم توجيه النقاط الخضراء الثلاث بفصل 120 درجة. هذه الزاوية ، التي تساوي زاوية الرابطة ، تسمح للذرات بصد بعضها البعض بأقل قدر ممكن. لذلك ، فإن جزيءًا له ذرة مركزية متصل بثلاثة أشياء أخرى سيعتمد هندسة مستوية مثلثية.
ومع ذلك ، يتوقع VSCR أن زوجًا حرًا من الإلكترونات في الذرة المركزية سيشوه الشكل الهندسي. بالنسبة لحالة الطائرة المثلثية ، سيدفع هذا الزوج النقاط الخضراء الثلاثة إلى أسفل ، مما ينتج عنه هندسة هرمية مثلثية.
يمكن أن يحدث الشيء نفسه أيضًا مع مجسم الصورة. في كل الذرات مفصولة بطريقة أكثر استقرارا ممكن.
مؤشر
- 1 كيف تعرف مقدما الهندسة الجزيئية للذرة X?
- 2 أنواع
- 2.1 خطي
- 2.2 الزاوي
- 2.3 رباعي السطوح
- 2.4 ثلاثي الزوايا Bipyramid
- 2.5 ثماني السطوح
- 2.6 هندسة جزيئية أخرى
- 3 أمثلة
- 3.1 الهندسة الخطية
- 3.2 هندسة الزاوي
- 3.3 خطة مثلثية
- 3.4 رباعي السطوح
- 3.5 الهرم ثلاثي الزوايا
- 3.6 ثلاثي الزوايا Bipyramid
- 3.7 تتأرجح
- 3.8 شكل T
- 3.9 ثماني السطوح
- 4 المراجع
كيفية معرفة مقدما الهندسة الجزيئية للذرة X?
لهذا ، من الضروري أيضًا النظر في أزواج الإلكترونات الحرة كمجموعات إلكترونية. هذه ، جنبا إلى جنب مع الذرات ، سوف تحدد ما يعرف باسم الهندسة الإلكترونية, وهو رفيق لا ينفصل عن الهندسة الجزيئية.
من الهندسة الإلكترونية ، وبعد أن اكتشفنا بنية لويس أزواج الإلكترونات الحرة ، يمكننا تحديد الشكل الهندسي الجزيئي. سيوفر مجموع جميع الأشكال الهندسية الجزيئية الخطوط العريضة للهيكل العالمي.
نوع
كما هو موضح في الصورة الرئيسية ، تعتمد الهندسة الجزيئية على عدد الذرات التي تحيط بالذرة المركزية. ومع ذلك ، إذا كان هناك زوج من الإلكترونات موجود بدون مشاركة ، فسيؤدي ذلك إلى تعديل الشكل الهندسي لأنه يشغل مساحة كبيرة. لذلك ، فإنه يمارس تأثير ستريك.
وفقًا لهذا ، يمكن للهندسة تقديم سلسلة من الأشكال المميزة للعديد من الجزيئات. وهذا هو المكان الذي تنشأ فيه أنواع مختلفة من الهندسة الجزيئية أو التركيب الجزيئي.
متى تساوي الهندسة الهيكلية؟ يشير كلاهما إلى نفس الشيء فقط في الحالات التي لا تحتوي فيها البنية على أكثر من نوع واحد من الأشكال الهندسية ؛ خلاف ذلك ، يجب النظر في جميع الأنواع الحالية وإعطاء البنية اسمًا عالميًا (خطي ، متفرّع ، كروي ، مسطح ، إلخ.).
تعتبر الأشكال الهندسية مفيدة بشكل خاص لشرح بنية المادة الصلبة من وحداتها الهيكلية.
خطي
جميع الروابط التساهمية اتجاهية ، وبالتالي فإن الرابط A-B خطي. ولكن هل سيكون جزيء AB خطيًا؟2? إذا كانت الإجابة بنعم ، يتم تمثيل الهندسة ببساطة على النحو التالي: B-A-B. يتم فصل ذرتين B بزاوية 180 درجة ، ووفقًا لـ TEV ، يجب أن تحتوي A على مدارات هجينة sp.
زاوي
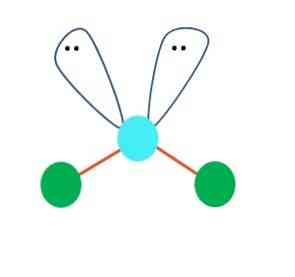
يمكن الافتراض في المقام الأول هندسة خطية لجزيء AB2. ومع ذلك ، من الضروري رسم بنية لويس قبل الوصول إلى نتيجة. رسم هيكل لويس ، يمكن للمرء تحديد عدد أزواج الإلكترونات دون مشاركة (:) على ذرة A.
عندما يكون الأمر كذلك ، على أزواج الإلكترون ، يدفعون ذرتين B لأسفل ، متغيرين زاويتهما. نتيجة لذلك ، ينتهي الجزيء الخطي B-A-B ليصبح V أو boomerang أو هندسة زاوية (الصورة العليا)
جزيء الماء ، H-O-H ، هو المثال المثالي لهذا النوع من الهندسة. يوجد في ذرة الأكسجين زوجان من الإلكترونات بدون مشاركة موجهة نحو زاوية تقريبية تبلغ 109º.
لماذا هذه الزاوية؟ لأن الهندسة الإلكترونية هي عبارة عن رباعي السطوح ، والذي يحتوي على أربعة رؤوس: اثنان لذرات H ، واثنان للإلكترونات. في الصورة أعلاه ، لاحظ أن النقاط الخضراء و "الفصوص ذات العينين" يرسمان رباعي الاسطح بنقطة زرقاء في مركزه.
إذا لم يكن لدى O زوج من الإلكترونات الحرة ، فستكون المياه جزيئًا خطيًا ، وستقل قطبيةها ، وربما لن تكون المحيطات والبحار والبحيرات وما إلى ذلك ، كما هي معروفة.
رباعي السطوح
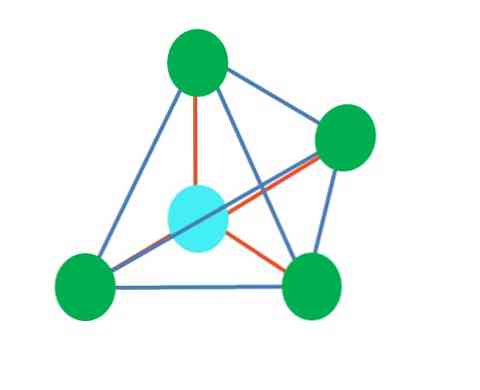
الصورة العليا تمثل هندسة رباعي السطوح. بالنسبة لجزيء الماء ، فإن هندسته الإلكترونية عبارة عن رباعي السطوح ، لكن من خلال القضاء على الأزواج الخالية من الإلكترون ، يمكن ملاحظة أنه يتحول إلى هندسة زاويّة. ويلاحظ هذا أيضًا ببساطة عن طريق إزالة نقطتين أخضر ؛ سوف اثنين المتبقية رسم الخامس مع النقطة الزرقاء.
ماذا لو كان هناك واحد فقط بدلا من اثنين من الإلكترونات الحرة؟ ثم سيكون هناك طائرة مثلثية (الصورة الرئيسية). ومع ذلك ، من خلال القضاء على مجموعة إلكترونية ، لا يتم تجنب التأثير الاستاتيكي الناتج عن زوج الإلكترونات الحرة. لذلك ، فإنه يشوه الطائرة المثلثية إلى هرم قاعدة الثلاثي:

على الرغم من اختلاف الهندسة الجزيئية مثلثية ورباعية السطوح ، فإن الهندسة الإلكترونية هي نفسها: رباعي السطوح. وبالتالي فإن الهرم الثلاثي لا يعتبر هندسة إلكترونية?
الجواب هو لا ، لأنه ناتج عن التشويه الناجم عن "الفص مع العينين" وتأثيره الاستاتيكي ، وهذه الهندسة لا تأخذ في الاعتبار التشوهات اللاحقة.
لهذا السبب ، من المهم دائمًا تحديد الهندسة الإلكترونية أولاً بمساعدة هياكل لويس قبل تحديد الهندسة الجزيئية. جزيء الأمونيا ، NH3, مثال على الهندسة الجزيئية للهرم ثلاثي الزوايا ، ولكن مع هندسة رباعية السطوح الإلكترونية.
Trigonal Bipyramid
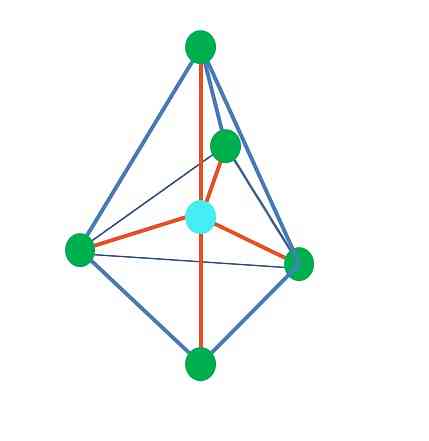
حتى الآن ، باستثناء الهندسة الخطية ، في رباعي السطوح ، يكون للهرم الزاوي والمثلث الثلاثي ذراتها المركزية تهجين س3, وفقا ل TEV. هذا يعني أنه إذا تم تحديد زوايا الارتباط الخاصة بك بشكل تجريبي ، فيجب أن تكون حوالي 109º.
من هندسة مثلث ثنائي الشكل ، توجد خمس مجموعات إلكترونية حول الذرة المركزية. في الصورة العلوية ، يمكنك رؤية النقاط الخمس الخضراء ؛ ثلاثة في قاعدة الثلاثي ، واثنين في المواقف المحورية ، والتي هي القمم العلوية والسفلية للهرم.
ما التهجين لا النقطة الزرقاء لديها بعد ذلك؟ يحتاج إلى خمس مدارات هجينة لتكوين روابط بسيطة (برتقالية). ويتحقق ذلك من خلال المدارات الخمسة sp3د (نتاج خليط المدار s ، ثلاث p و d).
عند التفكير في خمس مجموعات إلكترونية ، فإن الهندسة هي المجموعة المكشوفة بالفعل ، ولكن لديها أزواج من الإلكترونات دون مشاركة ، وتعاني هذه المجموعة مرة أخرى من تشوهات تولد أشكالًا هندسية أخرى. أيضًا ، يطرح السؤال التالي: هل يمكن لهذه الأزواج شغل أي منصب في الهرم؟ هذه هي: المحوري أو الاستوائي.
المواقف المحورية والاستوائية
النقاط الخضراء التي تشكل القاعدة المثلثية هي في مواضع استوائية ، في حين أن النقطتين في الأطراف العلوية والسفلية في المواضع المحورية. من المفضل ، أين سيكون موقع زوج الإلكترونات بدون مشاركة؟ في هذا الموقف الذي يقلل من التنافر الكهربائي وتأثير ستريك.
في الموضع المحوري ، يقوم زوج من الإلكترونات "بالضغط" بشكل عمودي (90 درجة) على القاعدة الثلاثية ، بينما إذا كانت في موقف استوائي ، فإن المجموعتين الإلكترونيتين المتبقيتين من القاعدة ستكونان متباعدين بمقدار 120 درجة والضغط على كلا الطرفين عند 90 درجة (بدلاً من ثلاثة ، كما هو الحال مع القاعدة).
لذلك ، ستسعى الذرة المركزية إلى توجيه أزواجها الخالية من الإلكترون في المواضع الاستوائية لتوليد هندسة جزيئية أكثر استقرارًا.
تتأرجح وشكل T
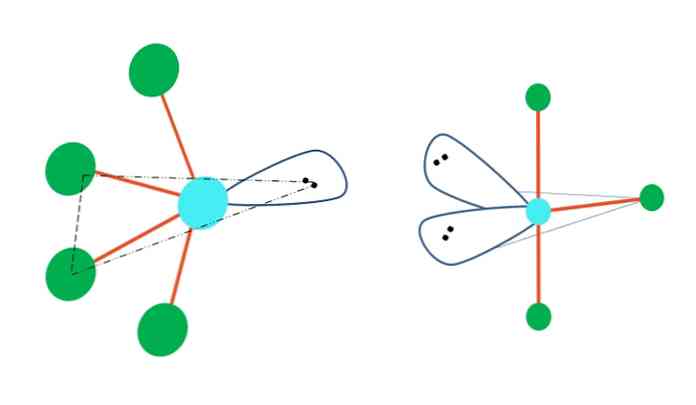
إذا كانت الهندسة ذات الثلاثية الأزمنة تحل محل واحد أو أكثر من ذراتها بأزواج خالية من الإلكترون ، فسيكون لها أيضًا هندسة جزيئية مختلفة.
على يسار الصورة العليا ، تتغير الهندسة إلى الشكل المتذبذب. في ذلك ، يدفع زوج الإلكترونات الحر بقية الذرات الأربع في نفس الاتجاه ، مطويًا روابطها إلى اليسار. لاحظ أن هذا الزوج واثنان من الذرات يقعان في نفس المستوى الثلاثي للهرم الأصلي.
وعلى يمين الصورة ، الشكل الهندسي على شكل حرف T. هذه الهندسة الجزيئية هي نتيجة استبدال ذرتين بزوجين من الإلكترونات ، مما أدى إلى تماشي الذرات الثلاثة المتبقية في نفس المستوى الذي يرسم حرفًا واحدًا بالضبط تي.
لذلك ، لجزيء من نوع AB5, وهي تعتمد هندسة مثلث bipyramid. ومع ذلك ، AB4, مع نفس الهندسة الإلكترونية ، فإنه سوف يعتمد هندسة تتأرجح. و AB3, هندسة على شكل T. في كل منهم سوف يكون A (عموما) تهجين sp3د.
لتحديد الهندسة الجزيئية ، من الضروري رسم بنية لويس وبالتالي هندسةها الإلكترونية. إذا كان هذا عبارة عن هرم ثلاثي الزوايا ، فسيتم التخلص من الأزواج الخالية من الإلكترون ، لكن ليس آثارها الجامدة على بقية الذرات. وبالتالي ، فمن الممكن التمييز بشكل مثالي بين الأشكال الجزيئية الثلاثة الممكنة.
ثماني السطوح
تُمثل الهندسة الجزيئية الثماني السطحية على يمين الصورة الرئيسية. هذا النوع من الهندسة يتوافق مع مركبات AB6. AB4 أنها تشكل قاعدة مربعة ، في حين يتم وضع اثنين المتبقية B في المواقف المحورية. وبالتالي ، يتم تشكيل العديد من المثلثات متساوية الأضلاع ، والتي هي وجوه من المجسم الثماني.
هنا ، مرة أخرى ، قد يكون هناك (كما هو الحال في جميع الأشكال الهندسية الإلكترونية) أزواج إلكترونية مجانية ، وبالتالي فإن الأشكال الهندسية الجزيئية الأخرى مشتقة من هذه الحقيقة. على سبيل المثال ، AB5 مع الهندسة الإلكترونية ثماني السطوح يتكون من الهرم مع قاعدة مربعة ، و AB4 طائرة مربعة:
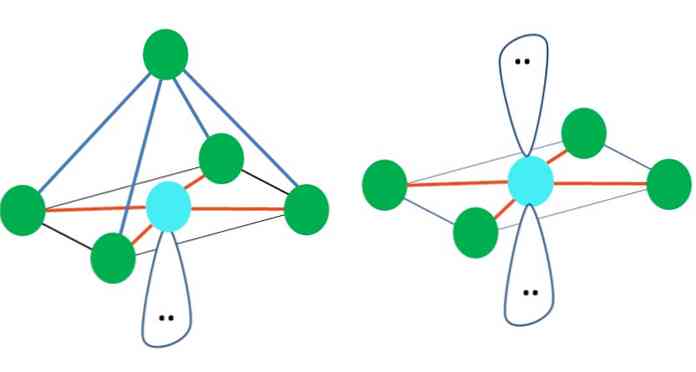
بالنسبة للهندسة الإلكترونية ذات ثماني السطوح ، فإن هذين الشكلين من الأشكال الجزيئية هما الأكثر ثباتًا من حيث التنافر الكهروستاتيكي. في هندسة المربعات المستوية ، يفصل بين أزواج الإلكترون 180 درجة.
ما هو تهجين الذرة A في هذه الأشكال الهندسية (أو الهياكل ، إذا كانت هي الوحيدة)؟ مرة أخرى ، يثبت TEV أنه sp3د2, ستة مدارات هجينة ، والتي تسمح لـ A بتوجيه المجموعات الإلكترونية في رؤوس المثمن.
هندسة جزيئية أخرى
عن طريق تعديل قواعد الأهرامات المذكورة حتى الآن ، يمكن الحصول على بعض الأشكال الهندسية الجزيئية الأكثر تعقيدًا. على سبيل المثال ، يعتمد bipyramid bentagonal على pentagon والمركبات التي تشكله لها صيغة عامة AB7.
مثل هندسة الجزيئات الأخرى ، فإن استبدال ذرات B للأزواج الخالية من الإلكترون سيؤدي إلى تشويه الهندسة إلى أشكال أخرى.
أيضا ، مركبات AB8 يمكن أن يتبنوا هندسة مثل antiprism مربع. قد تكون بعض الأشكال الهندسية معقدة للغاية ، خاصة بالنسبة لصيغ AB7 فصاعدا (حتى AB12).
أمثلة
بعد ذلك ، سيتم ذكر سلسلة من المركبات لكل هندسة جزيئية رئيسية. كتمرين ، يمكنك رسم هياكل لويس لجميع الأمثلة والتصديق على ما إذا كنت ، بالنظر إلى الهندسة الإلكترونية ، تحصل على الأشكال الهندسية الجزيئية كما هو موضح أدناه..
الهندسة الخطية
-الاثيلين ، ح2C≡CH2
-كلوريد البريليوم ، بيكل2 (CL-كن-CL)
-ثاني أكسيد الكربون ، CO2 (O = C = O)
-نيتروجين ، ن2 (N≡N)
-ديبروميد الزئبق ، HgBr2 (BR-الزئبق-BR)
-أنيون ثلاثي يود ، أنا3- (I-I-I)
-سيانيد الهيدروجين ، HCN (H-N≡C)
يجب أن تكون زاويته 180 درجة ، وبالتالي يكون له تهجين sp.
هندسة الزاوي
-الماء
-ثاني أكسيد الكبريت ، SO2
-ثاني أكسيد النيتروجين ، لا2
-الأوزون ، يا3
-أنيون amiduro ، NH2-
طائرة مثلثية
-بروم ثلاثي الفلوريد ، فرنك بلجيكي3
-تراي كلوريد الألومنيوم ، AlCl3
-نترات أنيون ، لا3-
-أنيون كربونات ، CO32-
رباعي السطوح
-غاز الميثان ، CH4
-رابع كلوريد الكربون ، CCl4
-الموجبة الأمونيوم ، NH4+
-أنيون سلفات ، SO42-
الهرم الثلاثي
-الأمونيا ، NH3
-الكاتيون الهيدرونيوم ، H3O+
Trigonal Bipyramid
-الفوسفور بنتافلوريد ، PF5
-الأنتيمون الخماسي الكلور5
متذبذب
رباعي فلوريد الكبريت ، SF4
شكل T
-اليود تراي كلوريد ، ICL3
-كلوريد ثلاثي فلوريد ، ClF3 (يعرف كلا المركبين باسم interhalogens)
ثماني السطوح
-سداسي فلوريد الكبريت ، SF6
-السيلينيوم سداسي فلوريد ، سيف6
-هيكسافلوروفوسفات ، PF6-
لتتوج ، الهندسة الجزيئية هي ما يفسر ملاحظات الخصائص الكيميائية أو الفيزيائية للمادة. ومع ذلك ، يتم توجيهها وفقًا للهندسة الإلكترونية ، بحيث يجب تحديد الأخيرة دائمًا قبل الأولى.
مراجع
- بياض ، ديفيس ، بيك وستانلي. الكيمياء. (الطبعة الثامنة). CENGAGE Learning ، ص 194-198.
- رعشة واتكينز. (2008). كيمياء غير عضوية (الطبعة الرابعة ، ص 23 ، 24 ، 80 ، 169). مولودية جراو هيل.
- مارك إي تاكرمان. (2011). الهندسة الجزيئية ونظرية VSEPR. تم الاسترجاع من: nyu.edu
- كتاب الكيمياء الظاهري ، تشارلز إي. (2003). مقدمة في الهندسة الجزيئية. تم الاسترجاع من: chemistry.elmhurst.edu
- كيمياء LibreTexts. (8 سبتمبر 2016). هندسة الجزيئات. تم الاسترجاع من: chem.libretexts.org


