الأملاح العضوية الخواص الفيزيائية والكيميائية والاستخدامات والأمثلة
ال أملاح عضوية هم عدد كبير من المركبات الأيونية ذات خصائص لا حصر لها. وهي مستمدة سابقًا من مركب عضوي ، خضع لعملية تحول تسمح لها بأن تكون حاملة لشحنة ، وأيضًا ، تعتمد هويتها الكيميائية على الأيونات المرتبطة.
في الصورة أدناه ، تظهر صيغتان كيميائيتان عامتان للغاية للأملاح العضوية. يتم تفسير العنصر الأول ، R-AX ، على أنه مركب له بنية كربون ذرة أو مجموعة A تحمل شحنة موجبة + أو سالبة (-).
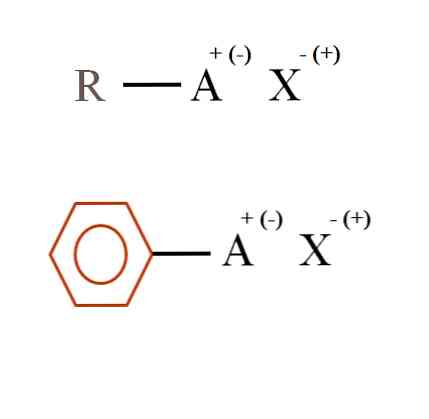
كما يتضح ، توجد رابطة تساهمية بين R و A و R-A ، ولكن بدورها ، يكون لشحنة رسمية تجذب (أو تطرد) أيون X. وستتوقف علامة الشحنة على طبيعة A والبيئة الكيميائية.
إذا كانت A إيجابية ، فكم من X يمكن أن يتفاعل معها؟ مع واحد فقط ، بالنظر إلى مبدأ الحيادية الإلكترونية (+ 1-1 = 0). ومع ذلك ، ما هي هوية X؟ أنيون X يمكن أن يكون CO32-, تتطلب اثنين الكاتيونات RA+. هالوجينيد: F-, الكلورين-, ر-, الخ أو حتى مجمع RA آخر-. الخيارات لا حصر لها.
أيضا ، يمكن أن يكون للملح العضوي طابع عطري ، موضح في حلقة البنزين البني. ملح بنزوات النحاس (II) ، (C6H5COO)2يتكون Cu ، على سبيل المثال ، من حلقتين عطريتين مع مجموعات carboxyl سالبة الشحنة ، والتي تتفاعل مع cation.2+.
مؤشر
- 1 الخصائص الفيزيائية والكيميائية
- 1.1 الكتل الجزيئية العالية
- 1.2 البرمائيات والسطحي
- 1.3 درجة الغليان أو انصهار عالية
- 1.4 الحموضة والأساسية
- 2 الاستخدامات
- 3 أمثلة للأملاح العضوية
- 3.1 الكربوكسيل
- 3.2 الليثيوم diacryluprates
- 3.3 أملاح السلفونيوم
- 3.4 أملاح الأكسونيوم
- 3.5 أملاح
- 3.6 أملاح الديازونيوم
- 4 المراجع
الخصائص الفيزيائية والكيميائية
من الصورة ، يمكن القول أن الأملاح العضوية تتكون من ثلاثة مكونات: العضوية ، R أو Ar (الحلقة العطرية) ، ذرة أو مجموعة تحمل الشحنة الأيونية A ، والعاكس X.
مثلما يتم تعريف الهوية الكيميائية والهيكل الكيميائي بواسطة هذه المكونات ، لذلك تعتمد خصائصها عليها.
من هذه الحقيقة يمكن تلخيص بعض الخصائص العامة التي تلبي الغالبية العظمى من هذه الأملاح.
كتل جزيئية عالية
على افتراض أن أحادية أو متعددة الأيونات غير متساوية التكافؤ ، فإن الأملاح العضوية عادة ما يكون لها كتل جزيئية أكبر بكثير من الأملاح غير العضوية. ويرجع ذلك أساسًا إلى الهيكل العظمي الكربوني الذي تسهم روابطه البسيطة C-C وذراتها الهيدروجينية في كتلة كبيرة من المركب.
لذلك ، فهي R أو Ar مسؤولة عن الأوزان الجزيئية العالية.
البرمائيات والسطحي
الأملاح العضوية هي مركبات برمائية ، أي أن بنياتها لها نهايات مضادة للماء وكارهة للماء..
ما هي هذه التطرف؟ تمثل R أو Ar النهاية الكارهة للماء ، لأن ذرات C و H ليست لها صلة كبيرة بجزيئات الماء.
A+(-), الذرة أو المجموعة التي تحمل الشحنة ، هي النهاية المحبة للماء ، حيث إنها تساهم في اللحظة الثنائية القطب وتتفاعل مع ثنائيات أقطاب تكوين الماء (RA+ OH2).
عندما يتم استقطاب المناطق المحبة للماء والكارهة للماء ، يصبح ملح البرمائيات مادة خافضة للتوتر السطحي ، وهي مادة تستخدم على نطاق واسع لتصنيع المنظفات و مفككات الزيت المستحلب.
درجة الغليان أو الانصهار عالية
مثل الأملاح غير العضوية ، تمتلك الأملاح العضوية أيضًا نقاط انصهار وغليان عالية ، بسبب القوى الإلكتروستاتيكية التي تحكم الطور السائل أو الصلب.
ومع ذلك ، وجود عنصر عضوي R أو Ar ، وأنواع أخرى من قوات فان دير فالس (قوات لندن ، ثنائي القطب ، جسور الهيدروجين) التي تتنافس بطريقة معينة مع الالكتروستاتيكي.
لهذا السبب ، تكون الهياكل الصلبة أو السائلة للأملاح العضوية ، في المقام الأول ، أكثر تعقيدًا وتنوعًا. البعض منهم يمكن أن تتصرف مثل بلورات سائلة.
الحموضة والأساسية
الأملاح العضوية عادة ما تكون أحماض أو قواعد أقوى من الأملاح غير العضوية. هذا لأن A ، على سبيل المثال في أملاح الأمين ، له شحنة موجبة بسبب ارتباطه بهيدروجين إضافي: A+-H. ثم ، عند الاتصال مع قاعدة ، تبرع البروتون للعودة ليكون مركبًا محايدًا:
RA+H + B => RA + HB
ينتمي H إلى A ، ولكنه مكتوب أثناء تدخله في رد فعل التحييد.
من ناحية أخرى ، RA+ قد يكون جزيء كبير ، غير قادر على تكوين مواد صلبة مع شبكة بلورية مستقرة بما فيه الكفاية مع أنيون الهيدروكسيل أو الهيدروكسيل OH-.
عندما يكون هذا هو الحال ، الملح RA+OH- يتصرف كقاعدة قوية ؛ حتى أساسية مثل NaOH أو KOH:
RA+OH- + HCl => RACl + H2O
لاحظ في المعادلة الكيميائية أن Cl أنيون- يحل محل OH-, تشكيل الملح RA+الكلورين-.
تطبيقات
سوف يختلف استخدام الأملاح العضوية وفقًا لهوية R و Ar و A و X. علاوة على ذلك ، فإن التطبيق الذي يتم توجيههم إليه يعتمد أيضًا على نوع المادة الصلبة أو السائلة التي تتشكل منها. بعض العموميات في هذا الصدد هي:
-أنها بمثابة الكواشف لتوليف المركبات العضوية الأخرى. يمكن أن يكون RAX بمثابة "مانح" لسلسلة R لإضافته إلى مركب آخر ليحل محل مجموعة صادرة جيدة.
-إنها عوامل سطحية ، لذا يمكن استخدامها أيضًا كمواد تشحيم. يتم استخدام الأملاح المعدنية للكربوكسيل لهذا الغرض.
-أنها تسمح لتوليف مجموعة واسعة من الأصباغ.
أمثلة على الأملاح العضوية
carboxylates
تتفاعل أحماض الكربوكسيل مع هيدروكسيد في تفاعل تحييد ، مما يؤدي إلى أملاح الكربوكسيل: RCOO- M+. حيث م+ يمكن أن يكون أي الموجبة المعدنية (نا+, برميل2+, K+, وما إلى ذلك) أو الكاتيون الأمونيوم NH4+.
الأحماض الدهنية هي أحماض كربوكسيلية دهنية طويلة السلسلة ، ويمكن أن تكون مشبعة وغير مشبعة. حمض النخاع (CH) هو من بين المشبعة3(CH2)14COOH). هذا ينشأ الملح palmitate ، في حين أن حامض دهني (CH3(CH2)16COOH يشكل الملح الإستارات. تتكون الصابون من هذه الأملاح.
في حالة حمض البنزويك ، C6H5COOH (حيث C6H5- إنها حلقة بنزين) ، عندما تتفاعل مع قاعدة تشكل أملاح البنزوات. في جميع الكربوكسيل ، مجموعة -COO- يمثل A (RAX).
الليثيوم dupupupates
الليثيوم diacuprate مفيد في التخليق العضوي. صيغته هي [R-Cu-R]-لي+, حيث تحمل ذرة النحاس شحنة سالبة. هنا ، يمثل النحاس ذرة الصورة.
أملاح السلفونيوم
تتشكل من تفاعل كبريتيد عضوي مع هاليد ألكيل:
R2S + R'X => R2R'S+X
بالنسبة لهذه الأملاح ، تحمل ذرة الكبريت شحنة رسمية موجبة (S+) وجود ثلاث روابط تساهمية.
أملاح الأكسونيوم
أيضًا ، تتفاعل الإيثرات (النظير المؤكسج للكبريتيدات) مع الهيدروكيدات لتكوين أملاح الأكسونيوم:
ROR '+ HBr <=> RO+HR '+ Br-
يرتبط البروتون الحمضي لـ HBr بتساهمي ذرة الأكسجين في الأثير (R2O+-H) ، وتحميله بشكل إيجابي.
أمين الأملاح
يمكن أن تكون الأمينات أولية أو ثانوية أو ثلاثية أو رباعية ، وكذلك أملاحها. تتميز جميعها بوجود ذرة H مرتبطة بذرة النيتروجين.
لذلك ، RNH3+X- إنه ملح أمين أولي ؛ R2NH2+X-, أمين ثانوي ؛ R3NH+X-, من أمين العالي. و R4N+X-, أمين رباعي (ملح أمونيوم رباعي).
أملاح الديازونيوم
وأخيرا ، أملاح الديازونيوم (RN2+X-) أو أريلديازونيوم (Arn)2+X-) ، تمثل نقطة الانطلاق للعديد من المركبات العضوية ، وخاصة الأصباغ azo.
مراجع
- فرانسيس كاري. الكيمياء العضوية (الطبعة السادسة. ، ص 604-605 ، 697-698 ، 924). مولودية جراو هيل.
- غراهام سولومونز تي. دبليو ، كريج بي فرايل. الكيمياء العضوية. الأمينات. (الطبعة 10.). وايلي بلس.
- ويكيبيديا. (2018). الملح (الكيمياء). مأخوذة من: en.wikipedia.org
- ستيفن هاردينجر. (2017). مسرد مصور للكيمياء العضوية: أملاح. تم الاسترجاع من: chem.ucla.edu
- شيفرون أورونيت. (2011). Carboxylates. [PDF]. تم الاسترجاع من: oronite.com


