كبريتات الصوديوم الفورمولا ، خصائص ، هيكل ، التطبيقات
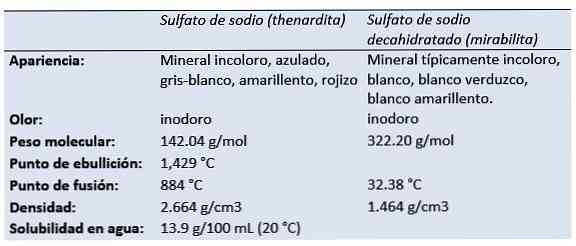
ال كبريتات الصوديوم (ملح الصوديوم من حامض الكبريتيك ، رباعي أكسيدوكسيد الصوديوم ، كبريتات الصودا ، ملح Glauber ، thenardite ، mirabilite) هو مركب غير عضوي مع الصيغة Na2SW4 وهيدرات ذات الصلة. جميع الأشكال عبارة عن مواد صلبة بيضاء ذات قابلية عالية للذوبان في الماء.
تعتبر واحدة من المنتجات الكيميائية الرئيسية التي يتم تسويقها. يبلغ إنتاجها في جميع أنحاء العالم (على وجه الحصر تقريبًا في صورة ديكايدرات) حوالي 6 ملايين طن سنويًا.

Thenardite هو معدن كبريتات الصوديوم اللامائي الذي يتم إنتاجه في البيئات القاحلة التبخرية ، في الكهوف الجافة ، في عمليات التعدين القديمة باعتبارها الإزهار ، وكوديعة حول الفومارول.
تم وصفه لأول مرة في عام 1825 في ساليناس إسبارتيناس (سيمبوزويلوس ، مدريد ، إسبانيا) وعين في حينه على شرف الكيميائي الفرنسي لويس جاك تينار (1777-1826).

اكتشف الكيميائي الهولندي والألماني يوهان رودولف جلوبر (1604-1670) في عام 1625 ، في مياه نبع نمساوي ، كبريتات الصوديوم ديكاهيدرات (المعروف لاحقًا باسم ملح غلوبر). أطلق عليه الملح mirabilis (الملح المعجزة) ، بسبب خصائصه الطبية.
بين عامي 1650 و 1660 ، بدأ Glauber في تصنيع كبريتات الصوديوم من الملح المشترك (NaCl) وحمض الكبريتيك المركز. تعتبر هذه العملية بداية الصناعة الكيميائية.
استخدمت بلوراتها كمسهل حتى القرن العشرين.
في القرن الثامن عشر ، بدأ استخدام ملح Glauber مع البوتاس (كربونات البوتاسيوم) في الإنتاج الصناعي لرماد الصودا (كربونات الصوديوم).

يستخدم حاليًا بشكل أساسي في صناعة المنظفات وفي عملية كرافت لإنتاج لب الورق (الطريقة السائدة في إنتاج الورق).
توجد رواسب معدن كبريتات الصوديوم في الولايات المتحدة وكندا وإسبانيا وإيطاليا وتركيا ورومانيا والمكسيك وبوتسوانا والصين ومصر ومنغوليا وجنوب إفريقيا..
المنتجون الرئيسيون هم الصين (مقاطعات جيانغسو وسيتشوان) ، تليها إسبانيا ، حيث يوجد أكبر مستودع للجلوبريت في العالم (في سيريزو دي ريو تيرون ، بورغوس).
يقدر إجمالي الإنتاج العالمي لكبريتات الصوديوم بحوالي 8 ملايين طن ، ويتم الحصول عليها كنتيجة ثانوية للعمليات الصناعية الأخرى بين 2 و 4 مليون طن..
في إسبانيا ، وفقًا للمعلومات المنشورة في الجرد الوطني لمصادر كبريتات الصوديوم والبيانات المحدّثة الأخرى ، تم تقدير المخزونات من معادن كبريتات الصوديوم بترتيب 730 مليون طن تم تصنيفها كـ "احتياطيات" ، و 300 مليون طن تم فهرستها كـ "موارد أخرى".
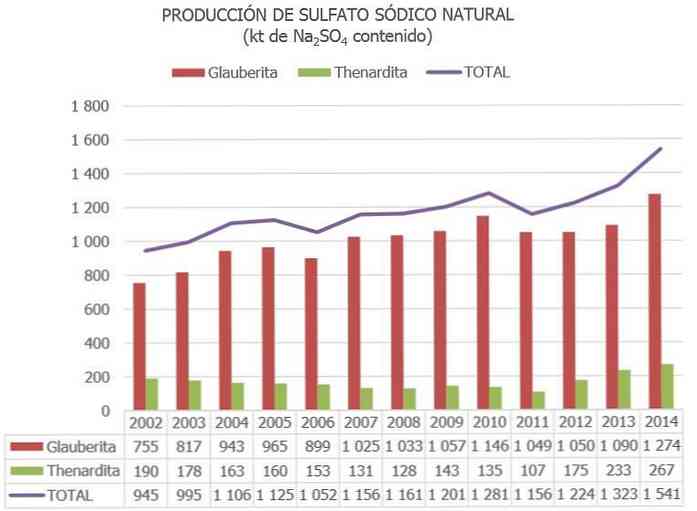
في الاتحاد الأوروبي ، تعد إسبانيا حاليًا الدولة الوحيدة التي تحتوي على خامات كبريتات الصوديوم (بشكل أساسي من ثينارديت ، جلاوبيت و ميرابيليت).
يوجد حاليا انخفاض عام في الطلب على كبريتات الصوديوم في قطاع الغزل والنسيج.
في السنوات الأخيرة ، شهدت قطاعات أخرى مثل المنظفات بعض النمو ، في مناطق معينة ، بسبب انخفاض سعرها كمواد خام.
توجد أسواق التوسع الرئيسية لمنظفات سلفات الصوديوم في آسيا وأمريكا الوسطى وأمريكا الجنوبية.
الصيغ

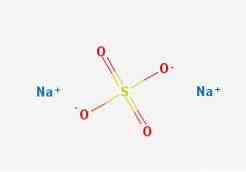
هيكل 2D
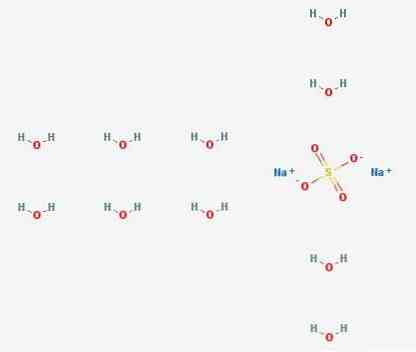
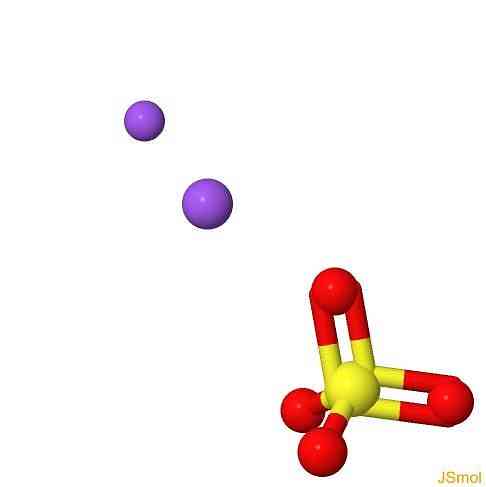
هيكل 3D
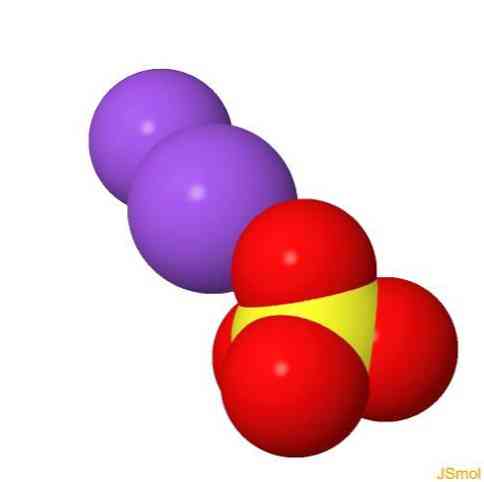
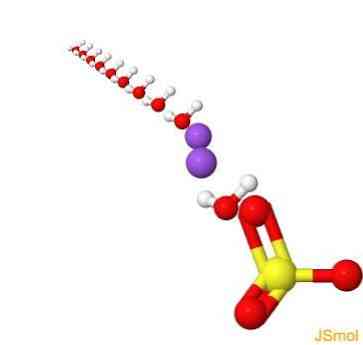
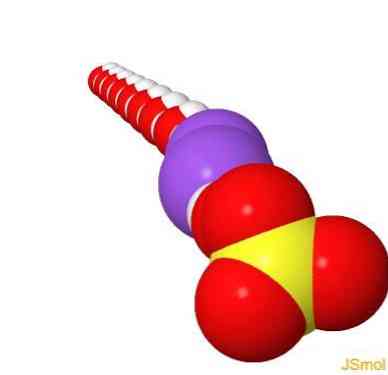
ملامح
الخصائص الفيزيائية والكيميائية
ينتمي سلفات الصوديوم إلى المجموعة التفاعلية لمركبات الصوديوم وينتمي أيضًا إلى مجموعة الكبريتات والهيدروجينسلفات والديسلفيت.
اللهوبية
إنها مادة غير قابلة للاحتراق. لا يوجد خطر من انفجار مساحيقها.
التفاعلية
كبريتات الصوديوم قابلة للذوبان للغاية في الماء واسترطابي. إنه مستقر للغاية ، كونه غير تفاعلي تجاه معظم العوامل المؤكسدة أو المختزلة في درجات الحرارة العادية. في درجات الحرارة العالية ، يمكن تحويله إلى كبريتيد الصوديوم عن طريق الحد من carbothermal.
تعتبر المواد غير المتفاعلة كيميائيًا غير متفاعلة في ظل ظروف بيئية نموذجية (على الرغم من أنها قد تتفاعل في الظروف القاسية نسبيًا أو في الحفاز). إنها مقاومة للأكسدة والاختزال (إلا في الظروف القاسية).
التفاعلات الكيميائية الخطرة
عندما يتم صهر الألومنيوم مع كبريتات الصوديوم أو البوتاسيوم ، يحدث انفجار عنيف.
سمية
تعتبر المواد غير المتفاعلة كيميائيًا غير سامة (على الرغم من أن المواد الغازية من هذه المجموعة يمكن أن تكون بمثابة اختناقات).
على الرغم من أن سلفات الصوديوم تعتبر عمومًا غير سامة ، إلا أنه يجب التعامل معها بحذر. يمكن أن يسبب المسحوق الربو أو تهيج العين بشكل مؤقت. يمكن تجنب هذا الخطر من خلال ارتداء حماية العين وقناع الورق.
تطبيقات
تطبيقاته الرئيسية هي في تصنيع:
- مسحوق المنظفات.
- لب الورق.
- المنسوجات.
- زجاج.
- توليف الانزيمات (صناعة النبيذ).
- الغذاء البشري والحيواني.
- منتجات الصيدلية.
- الكيمياء الأساسية بشكل عام.
- عمليات الصلب.
- مسحوق المنظفات
كبريتات الصوديوم هي مادة رخيصة جدا. أكبر استخدام لها هو حشو في المنظفات المنزلية المسحوق ، وتستهلك تقريبا. 50 ٪ من الإنتاج العالمي. لا تشتمل المنظفات الجديدة المضغوطة أو السائلة على كبريتات الصوديوم ، لذلك هذا الاستخدام يتناقص.
استخدام آخر لكبريتات الصوديوم يتناقص في أهميته ، خاصة في الولايات المتحدة الأمريكية. وكندا ، في عملية كرافت لصناعة لب الخشب. التقدم في الكفاءة الحرارية لهذه العملية ، قلل بشكل كبير من الحاجة إلى كبريتات الصوديوم.
توفر صناعة الزجاج تطبيقًا مهمًا آخر لكبريتات الصوديوم. هذا هو ثاني أكبر تطبيق في أوروبا. يستخدم كبريتات الصوديوم للمساعدة في القضاء على فقاعات الهواء الصغيرة من الزجاج المصهور.
في اليابان ، يتمثل أكبر تطبيق لكبريتات الصوديوم في صناعة المنسوجات. كبريتات الصوديوم تساعد الأصباغ على الاختراق بالتساوي في الألياف ولا تتآكل الأوعية الفولاذ المقاوم للصدأ المستخدمة في الصباغة (على عكس كلوريد الصوديوم ، وهي الطريقة البديلة).
كبريتات الصوديوم مناسبة بشكل خاص لتخزين حرارة شمسية منخفضة الجودة (للنشر لاحقًا في تطبيقات التدفئة) نظرًا لقدرتها العالية على تخزين الحرارة أثناء تغير طورها من الصلب إلى السائل ، والذي يتم توفيره عند 32 درجة مئوية.
بالنسبة لتطبيقات التبريد ، يؤدي الخليط مع الملح المشترك لكلوريد الصوديوم (NaCl) إلى تقليل نقطة الانصهار إلى 18 درجة مئوية..
في المختبر ، تستخدم كبريتات الصوديوم اللامائية على نطاق واسع كعامل تجفيف خامل ، لإزالة آثار المياه من المحاليل العضوية. يكون نشاطه أبطأ من نشاط كبريتات المغنيسيوم ، ولكن يمكن استخدامه مع مجموعة متنوعة من المواد لأنه خامل كيميائيًا تمامًا.
تاريخيا كان يستخدم كبريتات الصوديوم (ملح جلوبر) كمسهل. إنه فعال للتخلص من بعض الأدوية مثل الأسيتامينوفين (الأسيتامينوفين) من الجسم بعد جرعة زائدة.
تشمل التطبيقات الأخرى لكبريتات الصوديوم ، استخدامه كمضاف في صناعة معطرات الهواء بالسجاد ، كمادة مضافة في علف الماشية ، وفي صناعة النشا.
الآثار السريرية
بالنسبة لتطبيقاته العلاجية ، ينتمي سلفات الصوديوم إلى فئة المسهلات الملحية والمسهلة المستخدمة في علاج الإمساك.
المسهلات المالحة هي أملاح تحتفظ بالسوائل في الأمعاء من خلال التأثير الأسموزي للملح غير الممتص ، مما ينتج عنه زيادة في التمعج بشكل غير مباشر.
يتم امتصاص المسالك المالحة بشكل سيئ بواسطة الجهاز الهضمي ، وبالتالي ، فمن غير المرجح أن تكون السمية الجهازية إلا إذا تم تناول كميات هائلة. ومع ذلك ، يمكن أن تتسبب التعرضات الكبيرة في حدوث تغيرات في الجفاف والكهارل ثانوية عن التأثيرات التناضحية للمركب.
يمكن أن يحدث تعاطي ملين مزمن في المرضى الذين يعانون من اضطرابات الأكل أو متلازمة مونشاوسين أو اضطرابات حقيقية. بشكل عام ، يعاني المرضى من الغثيان والقيء والإسهال المرتبط بالتشنج البطني. قد تشمل الآثار الوخيمة الجفاف ، انخفاض ضغط الدم ، ارتفاع حرارة الجسم ، وتشوهات الكهارل.
الأمن والمخاطر
بيانات الأخطار للنظام المنسق عالمياً لتصنيف المواد الكيميائية ووسمها (SGA).
النظام المنسق عالميا لتصنيف المواد الكيميائية ووسمها (SGA) هو نظام متفق عليه دوليا ، أنشأته الأمم المتحدة ليحل محل مختلف معايير التصنيف ووضع العلامات المستخدمة في مختلف البلدان من خلال استخدام معايير عالمية متسقة (الأمم المتحدة) المتحدة ، 2015).
فئات المخاطر (والفصل المقابل من GHS) ، ومعايير التصنيف والتسمية ، والتوصيات المتعلقة بكبريتات الصوديوم هي كما يلي (الوكالة الأوروبية للمواد الكيميائية ، 2017 ، الأمم المتحدة ، 2015 ، PubChem ، 2017):
فئات المخاطر من GHS
H315: يسبب تهيج الجلد [تحذير تآكل / تهيج الجلد - الفئة 2].
H317: قد يتسبب في تفاعلات حساسية الجلد [تحذير التحسس ، الجلد - الفئة 1].
H319: يسبب تهيج العين الشديد [تحذير تلف العين الشديد / تهيج العين - الفئة 2A].
H412: ضار بالكائنات المائية ذات الآثار الضارة طويلة الأمد [خطرة على البيئة المائية ، خطر طويل المدى - الفئة 3].
(PubChem ، 2017)
مدونات المجالس الاحترازية
P261 و P264 و P272 و P273 و P280 و P302 + P352 و P305 + P351 + P338 و P321 و P332 + P313 و P333 + P313 و P337 + P313 و P362 و P501.
مراجع
- ChemIDplus (2017) 3D هيكل 7757-82-6 - كبريتات الصوديوم اللامائية [صورة]. تم الاسترجاع من: chem.nlm.nih.gov.
- ChemIDplus (2017) هيكل ثلاثي الأبعاد 7727-73-3 - كبريتات الصوديوم [USP] [image]. تم الاسترجاع من: chem.nlm.nih.gov.
- Dyet، D. (2007) Thenardite Sodium sulfate قرب Sodaville Mineral County Nevada [image] تم الاسترجاع من: en.wikipedia.org.
- الوكالة الأوروبية للمواد الكيميائية (ECHA) ، (2017). ملخص التصنيف والتوسيم. التصنيف المنسق - الملحق السادس من اللائحة (EC) رقم 1272/2008 (لائحة CLP). كبريتات الصوديوم.
- Grumetisho (2012) Mirabilita [image] تم الاسترجاع من: es.wikipedia.org.
- بنك بيانات المواد الخطرة (HSDB). TOXNET. (2017). كبريتات الصوديوم بيثيسدا ، دكتوراه في الطب ، الاتحاد الأوروبي: المكتبة الوطنية للطب. تم الاسترجاع من: toxnet.nlm.nih.gov.
- معهد الجيولوجيا والتعدين في إسبانيا (IGME) (2016). GLAUBERITA-THENARDITA (كبريتات الصوديوم الطبيعية) 2014. بانوراما التعدين. تم الاسترجاع من: igme.es.
- المعهد الوطني للسلامة في العمل (INSHT). (2010). السجلات الدولية للسلامة الكيميائية. كبريتات الصوديوم. وزارة التشغيل والأمن. مدريد. هو عليه. تم الاسترجاع من: insht.es.
- Langbein Rise (2008) مستمر لب عجينة كرافت [صورة] تم استرجاعه من: wikimedia.org.
- الأمم المتحدة (2015). النظام المنسق عالميا لتصنيف ووسم المنتجات الكيميائية (SGA) الطبعة السادسة المنقحة. نيويورك ، الولايات المتحدة: منشورات الأمم المتحدة. تم الاسترجاع من: unece.org.
- المركز الوطني لمعلومات التكنولوجيا الحيوية. قاعدة بيانات PubChem (2016) كبريتات الصوديوم - هيكل PubChem [image] بيثيسدا ، دكتوراه في الطب ، الاتحاد الأوروبي: المكتبة الوطنية للطب. تم الاسترجاع من: pubchem.ncbi.nlm.nih.gov.
- المركز الوطني لمعلومات التكنولوجيا الحيوية. قاعدة بيانات PubChem (2016) كبريتات الصوديوم - هيكل PubChem [image] بيثيسدا ، دكتوراه في الطب ، الاتحاد الأوروبي: المكتبة الوطنية للطب.
- المركز الوطني لمعلومات التكنولوجيا الحيوية. قاعدة بيانات PubChem المركبة. (2017). كبريتات الصوديوم decahydrated. بيثيسدا ، دكتوراه في الطب ، الاتحاد الأوروبي: المكتبة الوطنية للطب. تم الاسترجاع من: pubchem.ncbi.nlm.nih.gov.
- المركز الوطني لمعلومات التكنولوجيا الحيوية. قاعدة بيانات PubChem المركبة. (2017). كبريتات الصوديوم بيثيسدا ، دكتوراه في الطب ، الاتحاد الأوروبي: المكتبة الوطنية للطب. تم الاسترجاع من: pubchem.ncbi.nlm.nih.gov.
- Walkerma (2005) كبريتات الصوديوم [image] تم الاسترجاع من: wikimedia.org.
- ويكيبيديا (2017) عملية كرافت. تم الاسترجاع من: wikipedia.org.
- ويكيبيديا (2017) ميرابيليتا. تم الاسترجاع من: wikipedia.org.
- ويكيبيديا (2017) ميرابيليت. تم الاسترجاع من: wikipedia.org.
- ويكيبيديا (2017) كبريتات الصوديوم. تم الاسترجاع من: wikipedia.org.
- Wikipedia (2017) Solfato di sodium deciodrate. تم الاسترجاع من: https://it.wikipedia.org.
- ويكيبيديا (2017) كبريتات الصوديوم. تم الاسترجاع من: wikipedia.org.
- ويكيبيديا (2017) Thenardita. تم الاسترجاع من: wikipedia.org.
- ويكيبيديا (2017) Thenardite. تم الاسترجاع من: .wikipedia.org.


