التركيب الكيميائي لكبريتيد الألومنيوم (Al2S3) ، التسمية ، الخواص
ال كبريتيد الألومنيوم (آل2S3) هو مركب كيميائي رمادي فاتح يتكون من أكسدة الألومنيوم المعدني بفقد الإلكترونات من مستوى الطاقة الأخير وتصبح كاتيون ، وعن طريق الحد من الكبريت غير المعدني ، عن طريق الفوز الإلكترونات الناتجة عن الألومنيوم وتصبح أنيون.
ولكي يحدث هذا ويمكن للألمنيوم أن ينتج إلكتروناته ، فمن الضروري تقديم ثلاثة ساتل مداري هجين3, التي تعطي إمكانية تشكيل روابط مع الإلكترونات من الكبريت.

تعني حساسية كبريتيد الألومنيوم في الماء أنه ، في وجود بخار الماء في الهواء ، يمكن أن يتفاعل لإنتاج هيدروكسيد الألومنيوم (Al (OH)).3) ، كبريتيد الهيدروجين (H2S) والهيدروجين (H2) الغاز. إذا كان الأخير يتراكم يمكن أن يسبب انفجار. لذلك ، يجب تصنيع عبوة كبريتيد الألومنيوم باستخدام حاويات محكمة الإغلاق.
من ناحية أخرى ، بما أن كبريتيد الألومنيوم له تفاعل مع الماء ، فإن هذا يجعله عنصرًا لا يحتوي على قابلية للذوبان في المذيب المذكور..
مؤشر
- 1 التركيب الكيميائي
- 1.1 الصيغة الجزيئية
- 1.2 الصيغة الهيكلية
- 2 خصائص
- 2.1 الخصائص الفيزيائية
- 2.2 الخواص الكيميائية
- 3 الاستخدامات والتطبيقات
- 3.1 في المكثفات الفائقة
- 3.2 في بطاريات الليثيوم الثانوية
- 4 مخاطر
- 4.1 إجراء الإسعافات الأولية
- 4.2 تدابير مكافحة الحرائق
- 5 المراجع
التركيب الكيميائي
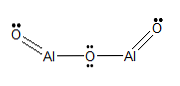
الصيغة الجزيئية
ل2S3
الصيغة الهيكلية
- كبريتيد الألومنيوم.
- دي تريسولفيد الألومنيوم.
- كبريتيد الألومنيوم (III).
- كبريتيد الألومنيوم.
خصائص
المركبات الكيميائية تظهر في الغالب نوعين من الخصائص: الفيزيائية والكيميائية.
الخصائص الفيزيائية
الكتلة المولية
150،158 جم / مول
كثافة
2.02 جم / مل
نقطة انصهار
1100 درجة مئوية
الذوبان في الماء
غير قابل للحل
الخواص الكيميائية
أحد التفاعلات الرئيسية لكبريتيد الألومنيوم مع الماء ، كركيزة أو كاشف رئيسي:

في هذا التفاعل ، يمكن ملاحظة تشكيل هيدروكسيد الألومنيوم وتكوين كبريتيد الهيدروجين إذا كان في شكل غاز ، أو كبريتيد الهيدروجين إذا تم إذابته في الماء كمحلول. يتم التعرف على وجودها من قبل رائحة البيض الفاسد.
يستخدم والتطبيقات
في المكثفات الفائقة
يستخدم كبريتيد الألومنيوم في تصنيع هياكل شبكة النانو التي تعمل على تحسين مساحة السطح والموصلية الكهربية المحددة ، بحيث يمكن تحقيق سعة عالية من الطاقة وكثافة طاقة يكون قابلاً للتطبيق من المكثفات الفائقة.
أكسيد الجرافين (GO) - يعد الجرافين أحد الأشكال الخاملة للكربون - وقد كان بمثابة دعم لكبريتيد الألومنيوم (Al2S3) مع مورفولوجيا هرمية مماثلة لتلك النانو مونتانا المصنعة باستخدام طريقة الحرارية المائية.
عمل أكسيد الجرافين
خصائص أكسيد الجرافين كدعم ، وكذلك الموصلية الكهربائية العالية ومساحة السطح ، تجعل nanorambutant Al2S3 أن تكون نشطة كهربائيا.
تؤكد منحنيات السعة المحددة للسيرة الذاتية وذات قمم الأكسدة المحددة بوضوح السلوك الزائف بالسعة للنانامبوتانيات Al2S3 هرمية ، مستدامة في أكسيد الجرافين في 1M هيدروكسيد الصوديوم بالكهرباء. قيم السيرة الذاتية المحددة التي تم الحصول عليها من المنحنيات هي: 168.97 بسرعة مسح تبلغ 5mV / s.
بالإضافة إلى ذلك ، لوحظ وجود وقت تفريغ غلفانوستاتي جيد قدره 903 ،s ، بسعة محددة كبيرة تبلغ 2178.16 عند الكثافة الحالية البالغة 3 مللي أمبير / سم2. تبلغ كثافة الطاقة المحسوبة من التفريغ الجلفاني 108.91 واط / كجم ، عند الكثافة الحالية البالغة 3 مللي أمبير / سم2.
وبذلك تؤكد المعاوقة الكهروكيميائية على الطبيعة الزائفة للسعة لهرمون الإلكترون النانوي المتمايل2S3. يُظهر اختبار ثبات القطب نسبة 57.44٪ من السعة المحددة التي تصل إلى 1000 دورة.
النتائج التجريبية تشير إلى أن nanorambutant آل2S3 التسلسل الهرمي مناسب لتطبيقات المكثف الفائق.
في بطاريات الليثيوم الثانوية
بهدف تطوير بطارية ليثيوم ثانوية ذات كثافة طاقة عالية ، كبريتيد الألومنيوم (Al2S3) كمادة نشطة.
قدرة التفريغ الأولي تقاس من آل2S3 كان ما يقرب من 1170 مللي أمبير ز -1 في 100 مللي أمبير ز -1. هذا يتوافق مع 62 ٪ من القدرة النظرية للكبريت.
ال2S3 أظهر استبقاءًا ضعيفًا للقدرة في النطاق المحتمل بين 0.01 فولت و 2.0 فولت ، ويرجع ذلك أساسًا إلى عدم الرجوع الهيكلي لعملية الشحن أو استخراج Li..
أشارت تحليلات XRD و K-XANES للألمنيوم والكبريت إلى أن سطح Al2S3 يتفاعل عكسيا خلال عمليات التحميل والتفريغ ، في حين أن آل الأساسية2S3 أظهرت عدم رجعية الهيكلية ، لأن LiAl و Li2تم تشكيل S من آل2S3 في التحميل الأولي وبعد ذلك بقوا كما كانوا.
المخاطر
- في اتصال مع الماء تطلق الغازات القابلة للاشتعال التي يمكن أن تحترق تلقائيا.
- يسبب تهيج الجلد.
- يسبب تهيج العين الشديد.
- قد يسبب تهيج الجهاز التنفسي.
قد تختلف المعلومات بين الإشعارات حسب الشوائب والإضافات وعوامل أخرى.
إجراء الإسعافات الأولية
العلاج العام
التماس العناية الطبية إذا استمرت الأعراض.
معاملة خاصة
لا شيء
أعراض مهمة
لا شيء
استنشاق
خذ الضحية في الهواء الطلق. قم بتزويد الأكسجين إذا كان التنفس صعبًا.
استيعاب
إدارة كوب واحد أو اثنين من الماء والحث على القيء. لا تحفز القيء أو إعطاء أي شيء عن طريق الفم لشخص فاقد الوعي.
بشرة
اغسل المنطقة المصابة بالماء والصابون المعتدل. قم بإزالة أي ملابس ملوثة.
عيون
اغسل عينيك بالماء ، وامض في كثير من الأحيان لعدة دقائق. أزل العدسات اللاصقة ، إن وجدت ، واصل الشطف.
تدابير مكافحة الحرائق
اللهوبية
غير قابلة للاشتعال.
اطفاء وسائل الإعلام
يتفاعل مع الماء. لا تستخدم الماء: استخدم CO2 والرمل ومسحوق الإطفاء.
إجراءات القتال
استخدم جهاز تنفس قائم بذاته كامل الوجه مع حماية كاملة. ارتداء الملابس لتجنب ملامسة الجلد والعينين.
مراجع
- Salud y Riesgos.com ، (s.f) ، التعريف ، المفاهيم والمقالات المتعلقة بالصحة ، المخاطر والبيئة. المستردة: saludyriesgos.com
- كبريتيد الألومنيوم. (S.f). على Wikiwand. تم الاسترجاع في 9 مارس 2018: wikiwand.com
- عناصر الويب. (S.f) .Dialuminium Trisulpfide ، تم العثور عليه في 10 مارس 2018: webelements.com
- إقبال ، م. ، حسن ، م. ، م. ، بيبي. ، بارفين ، ب. (2017). السعة العالية النوعية وكثافة الطاقة لأكسيد الجرافين المركب القائم على التسلسل الهرمي Al2S3 Nanorambutan لتطبيق Supercapacitor, Electrochimica Acta, المجلد 246 ,الصفحات ١٠٩٧-١٠٣
- Senoh، H.، Takeuchi، T.، Hiroyuki K.، Sakaebe، H.، M.، Nakanishi، K.، Ohta، T.، Sakai، T.، Yasuda، K. (2010). الخصائص الكهروكيميائية لكبريتيد الألومنيوم للاستخدام في الليثيوم.مجلة مصادر الطاقة,المجلد 195, العدد 24 ، الصفحات 8327-8330 doi.org
- LTS Research Laboratories، Inc (2016) ، ورقة بيانات السلامة كبريتيد الألومنيوم: ltschem.com