كبريتيد الصوديوم الصيغ ، الاستخدامات ، المخاطر
ال كبريتيد الصوديوم (Na2S) مادة صلبة بلورية من الأصفر إلى الأحمر. يوجد في الطبيعة بدرجات مختلفة من الترطيب ، كونه الأكثر شيوعا كبريتيد الصوديوم nonahydrate (Na2S · 9H2O).
إنها أملاح قابلة للذوبان في الماء تعطي محاليل قلوية قوية. عند التعرض للهواء الرطب ، فإنها تمتص الرطوبة من الهواء ، والتي يمكن أن تسخن تلقائيًا وتسبب في اشتعال المواد القابلة للاحتراق القريبة. وبالمثل ، عند ملامستها للهواء الرطب ، تنبعث منها كبريتيد الهيدروجين الذي تنبعث منه رائحة البيض الفاسد.

هم وكلاء الحد قوية. هذه المواد يمكن أن تكون خطرة على البيئة ، وخاصة بالنسبة للكائنات المائية.
أحادي سلفيد الصوديوم متاح تجاريا في شكل رقائق تحتوي على 60-62 ٪ من الصوديوم2S ...
- الصيغ

- CAS: 1313-82-2 كبريتيد الصوديوم (لا مائي)
- CAS: 1313-84-4 كبريتيد الصوديوم (غير مائي)
هيكل 2D
هيكل 3D
خصائص كبريتيد الصوديوم
الخصائص الفيزيائية والكيميائية

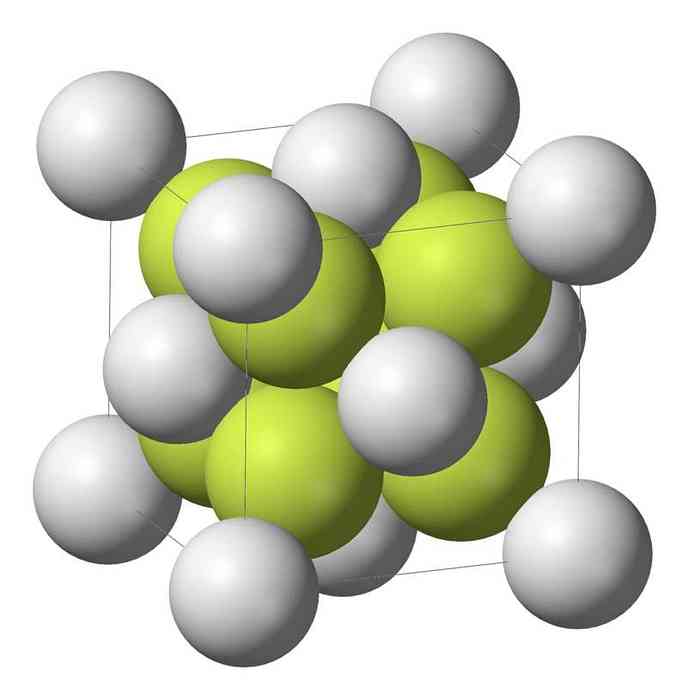
تتبلور أحادي سولفيد الصوديوم (Na2S) مع التركيب المضاد للفلوريات ، حيث يحيط كل ذرة S بمكعب من 8 ذرات Na وكل ذرة Na بواسطة رباعي السطوح يتكون من 4 ذرات S..
اللهوبية
العضو الوحيد عالي القابلية للاشتعال في مجموعة الكبريتيدات غير العضوية هو كبريتيد الهيدروجين. ومع ذلك ، فإن بعض الكبريتيدات غير العضوية الأخرى ، مثل كبريتيد الصوديوم ، يمكن أن تسخن تلقائيًا وحتى تشتعل إذا تعرضت للرطوبة..
عندما يتعرض للحريق ، يطلق كبريتيد الصوديوم غازات أو أبخرة ثاني أكسيد الكبريت ، الذي يسبب تهيجًا أو سامة.
التفاعلية
- الكبريتيدات غير العضوية أساسية بشكل عام (بعضها أساسي بقوة ، وبالتالي لا يتعارض مع الأحماض).
- العديد من هذه المركبات تعمل على تقليل العوامل (تتفاعل بقوة مع العوامل المؤكسدة).
- تتفاعل أملاح بسيطة من الكبريتيدات (مثل الصوديوم والبوتاسيوم وكبريتيد الأمونيوم) بقوة مع الأحماض لإطلاق غاز كبريتيد الهيدروجين شديد السمية والقابل للاشتعال.
- كبريتيد الصوديوم قابل للاشتعال. قد تنفجر عند تسخينها بسرعة أو ضربها.
- عند تسخينها حتى تتحلل ، تنبعث منها الأبخرة السامة من أكسيد الصوديوم وأكاسيد الكبريت.
- يتفاعل بعنف مع الكربون ، مع الفحم ، أملاح الديازونيوم ، N ، N-dichloromethylamine ، مضادات الأكسدة القوية ، والماء.
سمية
يتصرف العديد من أعضاء مجموعة الكبريتيدات غير العضوية كقواعد قوية ، ويمكن أن يتسببوا في حروق شديدة عندما يلامسون الجلد..
تعتمد هذه الخاصية على ذوبانها. الكبريتيدات غير العضوية غير القابلة للذوبان (على سبيل المثال ، كبريتيد الزئبق (II) وكبريتيد الكادميوم) ليست كاوية.
يحتوي كبريتيد الصوديوم على معامل فصل الأوكتانول / الماء (الأسرى) (-3.5). تُستخدم هذه القيمة كمقياس للذوبان (والتركيز الأحيائي) لمادة ما في الأنسجة الدهنية للحيوان (خاصة الحيوانات المائية).
يعتبر كبريتيد الصوديوم خطرا على البيئة ، وخاصة بالنسبة للكائنات المائية.
تطبيقات
في المنزل ، يستخدم كبريتيد الصوديوم في كشف الأنابيب ، والمنظفات المنزلية (للفرن ، والحمام) ، وأجهزة فرد الشعر ، وصابون الصحون وأكياس الهواء الآلية.
في الصناعة ، يتم استخدامه في المنظفات والأسمنت وكسلائف في إنتاج المنتجات الكيميائية الأخرى.
الآثار السريرية
يعد التعرض لكبريتيد الصوديوم شائعًا في البلدان المتقدمة والبلدان المتخلفة ، سواء في الصناعة أو في المنزل. هذه المواد المسببة للتآكل موجودة في العديد من المنتجات المنزلية بتركيز منخفض.
في البلدان المتقدمة ، والآثار الخطيرة نادرة. هذه تحدث أساسا بسبب تناول المادة الكيميائية في البالغين عن عمد. ومع ذلك ، في البلدان النامية ، والآثار الخطيرة أكثر شيوعا.
تسبب المواد المسببة للتآكل القلوية نخر بسبب التميع. صابون الدهون في غشاء الخلية ، وتدمير الخلية والسماح اختراق عميق في أنسجة الأغشية المخاطية.
التعرض عن طريق الفم
يحدث الالتهاب الأولي في الأنسجة المعدية المعوية ، تليها نخر الأنسجة (مع وجود ثقب محتمل) ، ثم التحبيب وأخيرا تشكيل تضيق.
مرضى الابتلاع الخفيف يصابون بتهيج أو حروق من الدرجة الأولى (احتقان سطحي وذمة) في البلعوم أو المريء أو المعدة.
قد يصاب مرضى التسمم المعتدل بحروق من الدرجة الثانية (تقرحات سطحية وتآكل وتقرحات) مع احتمال حدوث مزيد من التضيق (خاصة المريء).
قد يصاب بعض المرضى (وخاصة الأطفال الصغار) بالوذمة في الجهاز التنفسي العلوي.
يمكن للمرضى الذين يعانون من تسمم حاد عن طريق البلع تطوير حروق عميقة ونخر في الغشاء المخاطي المعوي ، مع مضاعفات مثل: ثقب (المريء ، المعدة ، نادرا الاثنى عشر) ، وتشكيل الناسور (القصبة الهوائية ، الأبهر المريئي) والنزيف المعوي.
يمكن أن تتطور: انخفاض ضغط الدم ، عدم انتظام دقات القلب ، عدم انتظام دقات القلب ، تكوين تضيق (أساسا المريء) ، سرطان المريء وذمة الجهاز التنفسي العلوي (وهو أمر شائع وغالبا ما يهدد الحياة).
التسمم الحاد يقتصر عموما على مآخذ متعمدة في البالغين.
التعرض عن طريق الاستنشاق
التعرض الخفيف يمكن أن يسبب السعال والتشنج القصبي.
الاستنشاق الحاد قد يسبب وذمة في الجهاز التنفسي العلوي ، والحروق ، والحاقن ، ونادراً ما ، إصابة رئوية حادة.
تعرض العين
يمكن أن تنتج تهيج الملتحمة الشديد والتشريح الكيميائي ، عيوب القرنية الظهارية ، نقص تروية الأطراف ، وفقدان البصر الدائم وفي الحالات الشديدة من ثقب..
تعرض الجلد
التعرض المعتدل يسبب تهيج وحروق سمك جزئية. الحماض الأيضي قد يحدث في المرضى الذين يعانون من حروق شديدة أو صدمة.
التعرض لفترات طويلة أو المنتجات عالية التركيز يمكن أن يسبب حروق السماكة الكلية.
الأمن والمخاطر
بيانات الأخطار للنظام المنسق عالمياً لتصنيف المواد الكيميائية ووسمها (SGA)
النظام المنسق عالمياً لتصنيف المواد الكيميائية ووسمها (SGA) هو نظام متفق عليه دولياً ، أنشأته الأمم المتحدة وصمم ليحل محل مختلف معايير التصنيف والتوسيم المستخدمة في مختلف البلدان باستخدام معايير متسقة في جميع أنحاء العالم.
فئات المخاطر (والفصل المقابل من GHS) ، ومعايير التصنيف والتسمية ، والتوصيات الخاصة بكبريتيد الصوديوم هي كما يلي (الوكالة الأوروبية للمواد الكيميائية ، 2017 ، الأمم المتحدة ، 2015 ، PubChem ، 2017):







مراجع
- Benjah-bmm27 ، (2006). Fluorite-unit-cell-3D-ionic [image] تم الاسترجاع من: wikipedia.org.
- ChemIDplus ، (2017). 1313-82-2 [image] تم الاسترجاع من: chem.nlm.nih.gov.
- ChemIDplus ، (2017). هيكل ثلاثي الأبعاد 1313-82-2 - كبريتيد الصوديوم [image] تم الاسترجاع من: chem.nlm.nih.gov.
- ChemIDplus ، (2017). هيكل ثلاثي الأبعاد 1313-84-4 - كبريتيد الصوديوم [image] تم الاسترجاع من: chem.nlm.nih.gov.
- الوكالة الأوروبية للمواد الكيميائية (ECHA). (2017). ملخص التصنيف والتوسيم.
- التصنيف المنسق - الملحق السادس من اللائحة (EC) رقم 1272/2008 (لائحة CLP). كبريتيد الصوديوم. تم الاسترجاع في 16 يناير 2017 ، من: echa.europa.eu.
- الوكالة الأوروبية للمواد الكيميائية (ECHA). (2017). ملخص التصنيف والتوسيم.
- التصنيف والإعلام المبلغ عنها. كبريتيد الصوديوم ، رطب. تم الاسترجاع في 16 يناير 2017 ، من: echa.europa.eu.
- بنك بيانات المواد الخطرة (HSDB). TOXNET. (2017). كبريتيد الصوديوم. بيثيسدا ، دكتوراه في الطب ، الاتحاد الأوروبي: المكتبة الوطنية للطب. تم الاسترجاع من: toxnet.nlm.nih.gov.
- Lange، L.، & Triebel، W. (2000). كبريتيد ، بولي سلفيدات ، وسلفانيس. في موسوعة أولمان للكيمياء الصناعية. Wiley-VCH Verlag GmbH & Co. KGaA. تم الاسترجاع من dx.doi.org.
- الأمم المتحدة (2015). النظام المنسق عالميا لتصنيف ووسم المنتجات الكيميائية (SGA) الطبعة السادسة المنقحة. نيويورك ، الولايات المتحدة: منشورات الأمم المتحدة. تم الاسترجاع من: unece.org.
- المركز الوطني لمعلومات التكنولوجيا الحيوية. قاعدة بيانات PubChem المركبة. (2016). كبريتيد الصوديوم enneahydrate - هيكل PubChem [صورة] تم استردادها من: pubchem.ncbi.nlm.nih.gov.
- المركز الوطني لمعلومات التكنولوجيا الحيوية. قاعدة بيانات PubChem المركبة. (2017). أحادي سولفيد الصوديوم. بيثيسدا ، دكتوراه في الطب ، الاتحاد الأوروبي: المكتبة الوطنية للطب. تم الاسترجاع من: pubchem.ncbi.nlm.nih.gov.
- المركز الوطني لمعلومات التكنولوجيا الحيوية. قاعدة بيانات PubChem المركبة. (2017). كبريتيد الصوديوم enneahydrate. بيثيسدا ، دكتوراه في الطب ، الاتحاد الأوروبي: المكتبة الوطنية للطب. تم الاسترجاع من: pubchem.ncbi.nlm.nih.gov.
- الإدارة الوطنية للمحيطات والغلاف الجوي (NOAA). المواد الكيميائية النقش. (2017). ورقة البيانات الكيميائية. كبريتيد الصوديوم ، اللامائية. الفضة الربيع ، MD. الاتحاد الأوروبي. تم الاسترجاع من: cameochemicals.noaa.gov.
- الإدارة الوطنية للمحيطات والغلاف الجوي (NOAA). المواد الكيميائية النقش. (2017). المجموعة التفاعلية ورقة البيانات. كبريتيد ، غير عضوية. الفضة الربيع ، MD. الاتحاد الأوروبي. تم الاسترجاع من: cameochemicals.noaa.gov.
- Ondřej Mangl ، (2007). Sulfid sodný - Na2S [image] تم الاسترجاع من: wikipedia.org.
- PubChem ، (2016). أحادي سلفيد الصوديوم [image] تم الاسترجاع من: puchem.nlm.nih.gov.
- PubChem ، (2016). كبريتيد الصوديوم enneahydrate [image] تم الاسترجاع من: puchem.nlm.nih.gov.
- ويكيبيديا. (2017). اوكتانول - معامل تقسيم الماء. تم استرجاعه في 17 يناير 2017 ، من: wikipedia.org.
- ويكيبيديا. (2017). كبريتيد الصوديوم. تم استرجاعه في 17 يناير 2017 ، من: wikipedia.org.


