نظرية بحر أساسيات الإلكترونات وخصائصها وعيوبها
ال نظرية الإلكترون للإلكترونات إنها فرضية تفسر ظاهرة كيميائية استثنائية تحدث في الروابط المعدنية بين العناصر ذات النغمات الإلكترونية المنخفضة. إنه يتعلق بمشاركة الإلكترونات بين الذرات المختلفة المرتبطة بالروابط المعدنية.
الكثافة الإلكترونية بين هذه الروابط هي أن الإلكترونات غير موضعية وتشكل "بحر" حيث تتحرك بحرية. يمكن التعبير عنها أيضًا بميكانيكا الكم: يتم ترتيب بعض الإلكترونات (عادةً واحدة إلى سبعة لكل ذرة) في مدارات مع مراكز متعددة ممتدة عبر السطح المعدني.
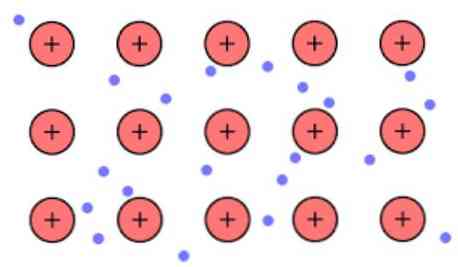
أيضًا ، تحتفظ الإلكترونات ببعض المواقع في المعدن ، على الرغم من أن توزيع احتمالية السحابة الإلكترونية له كثافة أعلى حول بعض الذرات المحددة. هذا يرجع إلى حقيقة أنه عند تطبيق تيار معين فإنها تظهر الموصلية الخاصة بهم في اتجاه معين.
مؤشر
- 1 أساسيات نظرية بحر الإلكترونات
- 2 خصائص
- 2.1 إزاحة في شكل طبقات
- 2.2 نظرية بحر الإلكترونات في البلورات المعدنية
- 3 عيوب النظرية
- 4 المراجع
أساسيات نظرية بحر الإلكترونات
تميل العناصر المعدنية بشكل كبير إلى التبرع بالإلكترونات من مستوى الطاقة الأخير (طبقة التكافؤ) ، نظرًا لأن طاقة التأين منخفضة جدًا مقارنة بالعناصر الأخرى.
مع العلم بذلك ، يمكن اعتبار كل عنصر معدني كاتيون مرتبط بالإلكترون من مستوى الطاقة الأخير ، والتي ستكون أكثر عرضة للتبرع.
كما هو الحال في المعدن لديك عدد كبير من الذرات المرتبطة ببعضها البعض ، يمكنك أن تفترض أن هذا المعدن يشكل مجموعة من الكاتيونات المعدنية التي منغمسة في نوع من بحر الإلكترونات التكافؤ التي لديها وفشورينغ كبيرة.
بالنظر إلى أن قوى الجذب الكهروستاتيكي الموجودة بين الكاتيون (الشحنة الموجبة) والإلكترون (الشحنة السالبة) لها ذرات معدنية مرتبطة ارتباطًا وثيقًا ، فإنها تتخيل عدم تحديد موقع إلكترونات التكافؤ التي تتصرف كمادة لاصقة كهروستاتيكية إلى الكاتيونات المعدنية.
وبهذه الطريقة ، يمكن استنتاج أنه كلما زاد عدد الإلكترونات الموجودة في طبقة التكافؤ من المعدن ، سيكون لهذا النوع من المواد اللاصقة الإلكتروستاتية قوة أكبر.
خصائص
تقدم نظرية بحر الإلكترونات شرحًا بسيطًا لخصائص الأنواع المعدنية مثل المقاومة والتوصيلية والليونة والقدرة على التحمل ، والتي تختلف من معدن إلى آخر.
لقد تم اكتشاف أن المقاومة الممنوحة للمعادن ترجع إلى الإزاحة الكبيرة لإلكتروناتها ، مما يولد قوة تماسك عالية للغاية بين الذرات التي تشكلها.
وبهذه الطريقة ، تُعرف الليونة بقدرة بعض المواد على السماح بتشوه بنيتها ، دون الخضوع بما يكفي للكسر ، عندما تتعرض لقوى معينة.
وفشورينغ في شكل طبقات
يتحدد كل من ليونة المعدن وقابليته للحركة من خلال حقيقة أن إلكترونات التكافؤ يتم تغيير اتجاهها في جميع الاتجاهات في شكل طبقات ، مما يجعلها تتحرك فوق بعضها البعض تحت تأثير قوة خارجية ، تجنب كسر الهيكل المعدني مع السماح بتشوهه.
وبالمثل ، تتيح حرية حركة الإلكترونات الموصلة أن يكون هناك تدفق للتيار الكهربائي ، مما يجعل الفلزات موصلة جيدة للكهرباء.
بالإضافة إلى ذلك ، تسمح هذه الظاهرة المتمثلة في حرية حركة الإلكترونات بنقل الطاقة الحركية بين المناطق المختلفة من المعدن ، مما يشجع على انتقال الحرارة ويسبب للمعادن بيان الموصلية الحرارية العالية.
نظرية بحر الإلكترونات في البلورات المعدنية
البلورات عبارة عن مواد صلبة لها خواص فيزيائية وكيميائية - مثل الكثافة ونقطة الانصهار والصلابة - والتي تنشأ عن نوع القوى التي تجعل الجزيئات التي تجعلها تبقى معًا.
بطريقة ما ، يعتبر أن بلورات من النوع المعدني لها أبسط الهياكل ، لأن كل "نقطة" من الشبكة البلورية تم احتلالها بواسطة ذرة المعدن نفسه.
بهذا المعنى نفسه ، تم تحديد أن بنية البلورات المعدنية بشكل عام مكعبة وتركز على الوجوه أو الجسم.
ومع ذلك ، يمكن أن تكون هذه الأنواع أيضًا سداسية الشكل ولها عبوة مدمجة إلى حد ما ، مما يمنحها هذه الكثافة الهائلة التي تتميز بها.
بسبب هذا السبب الهيكلي ، تختلف الروابط التي تتشكل في البلورات المعدنية عن تلك التي تحدث في الأنواع الأخرى من البلورات. تتم إزاحة الإلكترونات التي يمكنها تكوين روابط في جميع أنحاء الهيكل البلوري ، كما هو موضح أعلاه.
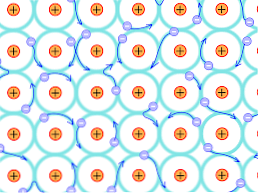
عيوب النظرية
يوجد في الذرات المعدنية كمية صغيرة من إلكترونات التكافؤ تتناسب مع مستوياتها النشطة ؛ أي أن هناك حالات طاقة متوفرة أكبر من كمية الإلكترونات المرتبطة.
هذا يعني أنه ، بما أن هناك إبطالًا إلكترونيًا قويًا وأيضًا أشرطة الطاقة التي تم شغلها جزئيًا ، يمكن للإلكترونات أن تتحرك عبر الهيكل الشبكي عندما تتعرض لحقل كهربائي قادم من الخارج ، بالإضافة إلى تكوين محيط الإلكترونات التي تدعم نفاذية الشبكة.
لذلك يتم تفسير اتحاد المعادن على أنه تكتل للأيونات الموجبة الشحنة يقترن بحر من الإلكترونات (شحنة سالبة).
ومع ذلك ، هناك خصائص لا يفسرها هذا النموذج ، مثل تكوين سبائك معينة بين المعادن ذات التركيبات الخاصة أو استقرار روابط المعادن الجماعية ، من بين أمور أخرى..
يتم تفسير هذه العيوب من خلال ميكانيكا الكم ، لأن هذه النظرية والعديد من الأساليب الأخرى تم تأسيسها استنادًا إلى أبسط نموذج للإلكترون الواحد ، مع محاولة تطبيق هياكل أكثر تعقيدًا من الذرات متعددة الإلكترون.
مراجع
- ويكيبيديا. (2018). ويكيبيديا. تم الاسترجاع من en.wikipedia.org
- Holman، J. S. and and Stone، P. (2001). الكيمياء. تم الاسترجاع من books.google.co.ve
- باركين ، ج. (2010). الرابطة المعدنية المعادن. تم الاسترجاع من books.google.co.ve
- روهر ، ج. س. (2001). الهيكل والترابط في المواد البلورية. تم الاسترجاع من books.google.co.ve
- Ibach، H.، Lüth، H. (2009). فيزياء الحالة الصلبة: مقدمة لمبادئ علوم المواد. تم الاسترجاع من books.google.co.ve


