صيغة أكسيد الليثيوم ، والخصائص والمخاطر والاستخدامات
ال أكسيد الليثيوم هو مركب كيميائي غير عضوي من الصيغة لي2أو التي تتشكل مع كميات صغيرة من بيروكسيد الليثيوم عندما يتم حرق معدن الليثيوم في الهواء ويضاف إلى الأكسجين.
حتى التسعينيات ، كان سوق المعادن والليثيوم يهيمن عليه الإنتاج الأمريكي من الرواسب المعدنية ، ولكن في بداية القرن الحادي والعشرين كان معظم الإنتاج مستمدًا من مصادر غير أمريكية. كانت أستراليا وتشيلي والبرتغال أهم الموردين في العالم. تمتلك بوليفيا نصف رواسب الليثيوم في العالم ، لكنها ليست منتجًا كبيرًا.
الشكل التجاري الأكثر أهمية هو كربونات الليثيوم ، لي2CO3, أنتجت من المعادن أو المحاليل الملحية بواسطة عدة عمليات مختلفة.
عندما يتم حرق الليثيوم في الهواء ، فإن المنتج الرئيسي هو الأكسيد الأبيض لأكسيد الليثيوم ، لي2بالإضافة إلى ذلك ، يتم إنتاج بعض بيروكسيد الليثيوم ، لي2O2, أبيض أيضا.
يمكن أن يتم ذلك أيضًا من خلال التحلل الحراري لهيدروكسيد الليثيوم ، LiOH ، أو بيروكسيد الليثيوم ، Li2O2
4Li (s) + O2(ز) → 2Li2يا (ق)
2LiOH (ق) + الحرارة → لى2يا (ق) + ح2يا (ز)
2Li2O2(ق) + الحرارة → 2Li2O (ق) + O2(G)
الخصائص الفيزيائية والكيميائية
أكسيد الليثيوم هو مادة صلبة بيضاء تعرف باسم الليتيا التي تفتقر إلى رائحة وطعم مالح. يظهر الشكل في الشكل 2 (المركز الوطني لمعلومات التكنولوجيا الحيوية ، 2017).

الشكل 2: ظهور أكسيد الليثيوم
أكسيد الليثيوم عبارة عن بلورات ذات هندسة مضادة للفلوريت تشبه تلك الخاصة بكلوريد الصوديوم (مكعب يتركز على الوجوه). ويرد هيكلها البلوري في الشكل 3 (مارك وينتر [جامعة شيفيلد و WebElements Ltd ، 2016].
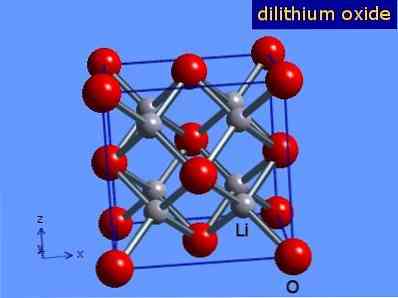
الشكل 3: التركيب البلوري لأكسيد الليثيوم.
وزنه الجزيئي هو 29.88 جم / مول ، وكثافته 2.013 جم / مل ونقاط الانصهار والغليان تبلغ 1438 درجة مئوية و 2066 درجة مئوية على التوالي. المركب قابل للذوبان في الماء والكحول والإثير والبيريدين والنتروبنزين (الجمعية الملكية للكيمياء ، 2015).
يتفاعل أكسيد الليثيوم بسهولة مع بخار الماء لتكوين هيدروكسيد ، وثاني أكسيد الكربون لتكوين كربونات ؛ لذلك ، يجب تخزينها ومعالجتها في جو نظيف وجاف.
مركبات الأكسيد لا تؤدي إلى الكهرباء. ومع ذلك ، فإن بعض أكاسيد البيروفسكايت المهيكلة عبارة عن الموصلات الإلكترونية التي تجد التطبيق في كاثود خلايا وقود الأكسيد الصلب وأنظمة توليد الأكسجين.
وهي مركبات تحتوي على أنيون أكسجين واحد على الأقل وكاتيون معدني واحد (American Elements، S.F).
التفاعل والمخاطر
أكسيد الليثيوم مركب مستقر لا يتوافق مع الأحماض القوية ، الماء وثاني أكسيد الكربون. على حد علمنا ، لم يتم التحقيق في الخصائص الكيميائية والفيزيائية والسمية ل أكسيد الليثيوم والإبلاغ عنها بعمق.
سمية مركبات الليثيوم هي وظيفة قابلية ذوبانها في الماء. ليثيوم أيون لديه سمية الجهاز العصبي المركزي. يكون المركب مهيجًا بدرجة عالية من التآكل إذا ملامس العينين ، الجلد ، عند الاستنشاق أو البلع (ESPI METALS ، 1993).
في حالة ملامسة العينين ، يجب عليك التحقق من ارتداء العدسات اللاصقة وإزالتها فورًا. يجب شطف العينين بالماء الجاري لمدة 15 دقيقة على الأقل ، مع إبقاء الأجفان مفتوحة. يمكنك استخدام الماء البارد. لا ينبغي أن تستخدم مرهم للعيون.
إذا كانت المادة الكيميائية تتلامس مع الملابس ، فقم بإزالتها في أسرع وقت ممكن ، وحماية يديك وجسمك. ضع الضحية تحت دش أمان.
إذا تراكمت المادة الكيميائية على الجلد المكشوف للضحية ، مثل اليدين ، اغسل البشرة الملوثة بالماء الجاري والصابون غير الكاشف برفق وحذر. يمكنك استخدام الماء البارد. إذا استمر الالتهاب ، فاطلب الرعاية الطبية. اغسل الملابس الملوثة قبل إعادة استخدامها.
في حالة الاستنشاق ، يجب السماح للضحية بالراحة في منطقة جيدة التهوية. إذا كان الاستنشاق شديدًا ، يجب نقل الضحية إلى منطقة آمنة في أسرع وقت ممكن.
قم بفك الملابس الضيقة مثل طوق القميص ، والأحزمة أو ربط العنق إذا وجدت الضحية صعوبة في التنفس ، يجب إعطاء الأكسجين. إذا لم تتنفس الضحية ، يتم إجراء إنعاش من الفم إلى الفم.
مع الأخذ في الاعتبار دائمًا أنه قد يكون خطيرًا على الشخص الذي يقدم المساعدة في الإنعاش من الفم إلى الفم عندما تكون المادة المستنشقة سامة أو معدية أو متآكلة.
في جميع الحالات ، يجب أن تطلب رعاية طبية فورية (SIGMA-ALDRICH ، 2010).
تطبيقات
يستخدم أكسيد الليثيوم كتدفق في الزجاج المزجج ، ويخلق اللون الأزرق مع النحاس والورود مع الكوبالت. يتفاعل أكسيد الليثيوم مع الماء والبخار ، ويشكل هيدروكسيد الليثيوم ويجب عزله عنها.
أكسيد الليثيوم (لي2O) مع إمكاناتها العالية للتريتيوم هو مرشح جذاب لمادة الاستزراع الصلبة لمحطة توليد انصهار DT ، بسبب كثافتها العالية من ذرات الليثيوم (مقارنة مع غيرها من سيراميك الليثيوم أو الليثيوم المعدني) وموصلية حراري عالي نسبيًا (الليثيوم أكسيد (Li2O) ، SF).
لي2أو سوف تتعرض لدرجات حرارة عالية تحت إشعاع النيوترونات أثناء تشغيل بطانيات الانصهار. في ظل هذه الظروف ، سيحدث عدد كبير من عيوب التشعيع في لي2أو ، مثل التورم الناجم عن الهليوم ، والتمدد الحراري العالي نسبيًا ، ونمو الحبوب ، وتكوين LiOH (T) والهطول في درجات حرارة منخفضة ونقل كتلة LiOH (T) في درجات حرارة عالية.
بالإضافة إلى ذلك ، لي2أو سيكون عرضة للضغوط الناجمة عن الاختلافات في التمدد الحراري بين لي2يا والمواد الهيكلية. هذه الخصائص لي2أو أنها تؤدي إلى مشاكل هندسية صعبة في كل من تصنيع وتصميم البطانيات.
الاستخدام المحتمل الجديد هو استبدال كبريت وأكسيد الليثيوم مثل الكاثود في بطاريات الليثيوم أيون المستخدمة لتشغيل الأجهزة الإلكترونية من الهواتف المحمولة إلى أجهزة الكمبيوتر المحمولة وكذلك السيارات التي تعمل بالبطاريات (Reade International Corp، 2016).
مراجع
- مارك وينتر [جامعة شيفيلد و WebElements المحدودة (2016). webelements. مأخوذة من الليثيوم: أكسيد الدليتيوم webelements.com.
- العناصر الأمريكية. (وس. ف.). أكسيد الليثيوم. مأخوذة من americanelements americanelements.com.
- المعادن ESPI. (1993 ، يونيو). أكسيد الليثيوم. مأخوذة من espimetals espimetals.com.
- الليثيوم أكسيد (Li2O). (وس. ف.). مأخوذة من ferp.ucsd.edu ferp.ucsd.edu.
- المركز الوطني لمعلومات التكنولوجيا الحيوية. (2017 ، 24 يونيو). قاعدة بيانات PubChem المركبة ؛ إدارة البحث الجنائي = 166630. مأخوذة من PubChem pubchem.ncbi.nlm.nih.gov.
- شركة ريدي الدولية (2016). مسحوق أكسيد الليثيوم (Li2O). مأخوذة من reade.com
- الجمعية الملكية للكيمياء. (2015). أكسيد الليثيوم.مأخوذة من chemspiderchemspider.com.
- SIGMA-ALDRICH. (2010). ورقة بيانات سلامة المواد أكسيد الليثيوم. مأخوذة من chemblink chemblink.com.


