المنغنيز أوكسيد (MnO2) التركيب الكيميائي ، والخصائص والاستخدامات
ال أكسيد المنغنيز (MNO2) عبارة عن مركب كيميائي غير عضوي يتكون من عنصر المنجنيز برقم أكسدة +4 وأكسجين ، ويكون له في تكوين الأكاسيد رقم أكسدة -2. ومن المعروف أيضا بأسماء أكسيد المنغنيز (IV) وأنغيد المنغنيز.
إنها صلبة من القهوة الداكنة إلى القهوة السوداء. إنه بطبيعته مثل البيرولوسيت المعدني ، التشعبات ذات اللون الأسود والمتبلور (استطالات متفرعة). يمكن الحصول عليها كمخلفات سوداء في التفاعل بين الإيثيلين وبرمنجنات البوتاسيوم بعد تشكيل الجليكول عن طريق العمل المؤكسد لبرمنجنات البوتاسيوم.

مهم جداً في صناعة الزجاج بسبب طابعه العامل المؤكسد ، لأنه يزيل اللون الأخضر القادم من المركبات الحديدية ويحولها إلى حديدية.
مؤشر
- 1 التركيب الكيميائي
- 2 خصائص
- 3 الاستخدامات
- 3.1 كمحفز
- 4 الآثار على الصحة
- 5 المراجع
التركيب الكيميائي
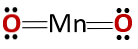
يتوافق التركيب الكيميائي للمركب مع أنهيدريد وليس مع أكسيد أكسيد ، كما هو متوقع لأنه يتكون من فلز وغير فلزي.
هذه الحالة الخاصة ناتجة عن السلوك الذي يفترضه المنجنيز في حالات الأكسدة المختلفة التي لديه. وبالتالي ، بالنسبة لحالات الأكسدة +2 و +3 تشكل الأكاسيد MnO و Mn2O3 على التوالي ، عندما تتفاعل مع الماء فإنها تشكل هيدروكسيد المنغنيز وهيدروكسيد المنغنيز ، على التوالي.
ومع ذلك ، فإن المنغنيز2O3 في وسط حمضي قليلاً يتصرف مثل أنهيدريد. مع حالات الأكسدة +4 ، +6 و +7 ، فإن MnO2, MnO3 و MNO4 أنها تشكل الأحماض عند التفاعل مع الماء.
في وسط الحمضية قليلا MnO2 يتصرف مثل أكسيد أساسي ، لذلك يمكن أن يشكل هيدروكسيد المقابلة.
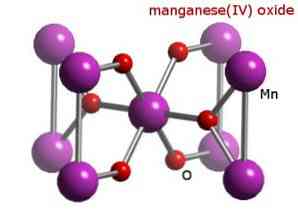

يجب ألا يغيب عن البال أنه في هذه الحالة لا يوجد ذكر لخصائص المذبذب ، والتي بموجبها يمكن أن يتصرف المركب كحمض أو كقاعدة. هذه حالة خاصة لسلوك المنغنيز.
خصائص
تطبيقات
- يتم استخدامه كمصدر للمنغنيز
- كمادة مؤكسدة في البطاريات القلوية
- دهانات للزجاج والسيراميك والخزف.
- في الحصول على الكلور واليود.
- في تحلل بيروكسيد الهيدروجين لتشكيل الأكسجين الغازي والماء.
- في رد فعل التحلل من كلورات البوتاسيوم لإنتاج الأكسجين الغازي وكلوريد البوتاسيوم.
- يذوب في الأسيتون أو في ثنائي كلورو ميثان ، يؤكسد الكحوليات الأولية إلى الألدهيدات والثانوية إلى الكيتونات.
- تصنيع البطاريات القلوية.
كمحفز
وهذا ينطبق على تفاعلات الحد من الأكسيد ، لإزالة الكبريتيدات مثل H2S والكاتيونات مثل الحديد+2 و مينيسوتا+2 , الزرنيخ والراديو الموجود في المياه الجوفية الملوثة بهذا النوع من المركبات.
يمكن أن ينتج هذا التلوث إما عن طريق الإلقاء غير المنضبط للمواد السامة ، أو عن طريق غسل التربة الملوثة أو عن طريق وجود عناصر كيميائية في وقت استخراج المياه..
MnO2 درجة نقاوة عالية تم الحصول عليها من البيرولوسيت المستخدم كمرشح (Filox) هي أكثر الوسائل فعالية لإزالة هذه الفئة من الشوائب من المياه الجوفية.
الآثار على الصحة
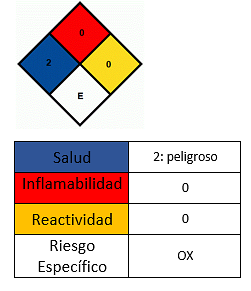
- تجنب ملامسة الجلد.
- في حالة الاتصال ، اغسل المنطقة المقابلة.
- لا تستنشق المساحيق.
- يمكن رؤية تهيج واحمرار عند ملامسة العين. تغسل مع الكثير من الماء ، والسماح للمياه بالمرور عبر العينين وطلب المساعدة الطبية في حالة خطيرة.
- في اتصال مع تهيج الجلد ويلاحظ احمرار. اغسل المنطقة المصابة بالكثير من الماء والصابون.
- ملامسة الجلد لفترات طويلة تزيل الدهون الطبيعية ، مما تسبب في التهاب الجلد.
- استنشاق يمكن أن يسبب حالة تشبه الانفلونزا (أبخرة معدنية). تتميز الحالة بحمى شديدة وقشعريرة وجفاف في الفم والحلق وآلام في العضلات وصداع.
- يمكن أن تهيج الجهاز التنفسي وزيادة حدوث التهابات الجهاز التنفسي (الالتهاب الرئوي). من غير المحتمل حدوث تسمم بامتصاص أملاح المنجنيز غير العضوي عبر الرئتين ، لكن التسمم المزمن يمكن أن يحدث.
- التعرض المزمن للغبار أو الأبخرة من ثاني أكسيد المنجنيز على مدى فترة طويلة يمكن أن يؤثر على الجهاز العصبي المركزي ويؤدي إلى تطور مرض باركنسون ، وصعوبات المشي ، وتشنجات العضلات والتغيرات السلوكية.
- قد يسبب الابتلاع ألم في البطن وغثيان.
- إنه غير قابل للاشتعال ، ولكنه يساعد على نشر النار في المواد المتوهجة. إذا تم تسخينها إلى درجة حرارة أعلى من 535 درجة مئوية ، تتحلل المادة إلى أكسيد المنغنيز (III) Mn2O3 والأكسجين ، وهو قابل للاشتعال ويزيد من خطر الحريق. في هذه الحالة يجب إطفاء الحريق بالرغوة أو ثاني أكسيد الكربون.
- في حالة الانسكاب ، لا تتلاعب بالمركب دون حماية شخصية مناسبة.
- قم بتخزين المركب في عبوات مغلقة بإحكام ، في مكان بارد وجاف وبعيدًا عن المواد غير المتوافقة مثل المواد العضوية والمواد القابلة للاحتراق.
- يجب أن يكون مكان التخزين جافًا وله أرضيات مقاومة للتآكل الحمضي وبتصريف جيد..
- يجب استخدام معدات الحماية الشخصية ، مثل القفازات ونظارات السلامة وأقنعة مرشح مكافحة البخار والغبار والدخان.
مراجع
- B ، (2015) ، ثاني أكسيد المنغنيز ، الجمعية الملكية للكيمياء - عالم الكيمياء ، تم استرجاعه من chemistryworld.com
- Karal ، (2014) ، ثاني أكسيد Mangneso ، ورقة بيانات السلامة ، تم استردادها من ، karal.com.mx
- المعلم الافتراضي الخاص بك (2015/02/25). مركبات المنغنيز غير العضوية (حالة خاصة 1) - درس نظري) ، تم استرجاعها من ، youtube.com
- Ecured ، (s.f) ، ثاني أكسيد المنغنيز ، المسترد من ecured.cu
- Angarita G ، جوني ، (2017) ، ثاني أكسيد المنغنيز: تقنية استثنائية. Hidroteco, تعافى من hydrotecocr.com
- فرنانديز ، G. ، (2015) ، ثاني أكسيد المنغنيز ثاني أكسيد2/ الأسيتون, الكيمياء العضوية, تعافى من quimicaorganica.net
- Tronox ، (2011) ، ثاني أكسيد المنغنيز ، ورقة بيانات السلامة ، المستردة من ، tronox.com


