غيمسا تلطيخ الأساس والمواد والتقنية والاستخدامات
ال غيمسا وصمة عار هو نوع من تلطيخ العينات السريرية ، استنادا إلى خليط من الأحماض والأصباغ الأساسية. استلهم تصميمه العمل الذي أنجزه رومانوفسكي ، حيث أتقنه غوستاف غيمسا ، الكيميائي والبكتري في الأصل من ألمانيا ، عن طريق إضافة الجلسرين لتثبيت المركبات..
التغييرات التي تم إنشاؤها على التقنية الأصلية لـ Romanowsky سمحت بتحسين الملاحظات المجهرية بشكل كبير ، لذلك تم تعميد هذه التقنية باسم وصمة جيمسا.
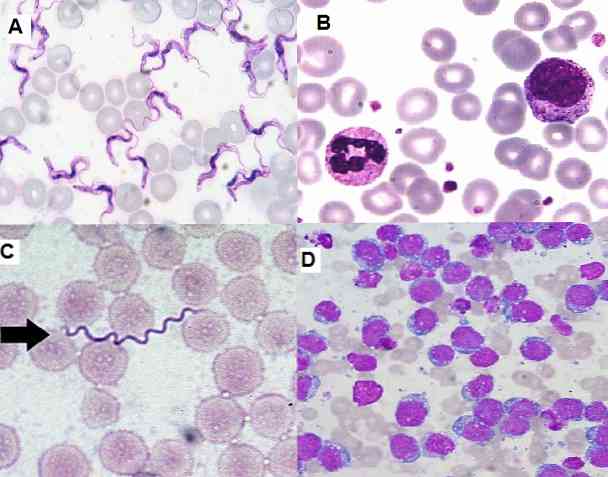
نظرًا لأنها تقنية بسيطة في الأداء وذات كفاءة وظيفية واقتصادية عالية ، فهي تستخدم حاليًا على نطاق واسع في المختبر السريري من أجل إجراء عمليات تشريح الدم وعينات النخاع العظمي وأقسام الأنسجة..
تقنية تلطيخ Giemsa مفيدة جدًا للدراسات الخلوية ، لأنها تتيح مراقبة هياكل محددة من الخلايا. هذه التقنية تلطخ الخلايا السيتوبلازمية ، النواة ، النواة ، الفجوات والحبيبات للخلايا ، لتكون قادرة على تمييز آثار الكروماتين الدقيقة..
بالإضافة إلى ذلك ، يمكن اكتشاف تغييرات كبيرة في حجم أو شكل أو تلوين النواة ، حيث يمكن تصور فقدان العلاقة بين النواة والسيتوبلازم.
من ناحية أخرى ، يسمح بتحديد الخلايا غير الناضجة في النخاع العظمي والدم المحيطي ، كونها مهمة لتشخيص الأمراض الخطيرة مثل سرطان الدم. من الممكن أيضًا اكتشاف الطفيليات ، والبكتيريا خارج الخلايا ، والفطريات ، وغيرها.
في علم الوراثة الخلوية ، يتم استخدامه تمامًا ، لأنه من الممكن دراسة انقسام الخلايا.
مؤشر
- 1 أساس تلوين جيمسا
- 2 المواد
- 2.1 مواد لإعداد الحل الأم
- 2.2 طريقة إعداد الحل الأم
- 2.3 مواد لإعداد الحل العازلة
- 2.4 التحضير النهائي للصبغة
- 2.5 المواد الإضافية اللازمة لأداء التلوين
- 3 تقنية
- 3.1 عملية تلطيخ
- 4 المرافق
- 4.1 أمراض الدم
- 4.2 الفطريات
- 4.3 علم الجراثيم
- 4.4 الطفيليات
- 4.5 علم الخلايا
- 4.6 علم الوراثة الخلوية
- 5 بحث يوضح فعالية تلطيخ جيمسا
- 6 توصيات لتلطيخ جيد
- 7 أخطاء شائعة في تلوين جيمسا
- 7.1 التلوين الأزرق للغاية
- 7.2 التلوين الوردي المفرط
- 7.3 وجود رواسب في اللطاخة
- 7.4 وجود القطع الأثرية
- 8 وضع التخزين
- 9 المراجع
أساس تلوين جيمسا
تعتمد أصباغ نوع Romanowsky على استخدام التباين بين الأصباغ الحمضية والأصباغ الأساسية ، لتحقيق تلطيخ الهياكل الأساسية والحمضية ، على التوالي. كما يمكن أن نرى تقارب الأصباغ الحمضية لصبغ الهياكل الأساسية والعكس صحيح.
الصبغة الأساسية المستخدمة هي أزرق الميثيلين ومشتقاته المؤكسدة (Azure A و Azure B) ، بينما الصبغة الحمضية هي eosin.
الهياكل الحمضية للخلايا هي الأحماض النووية ، حبيبات الخلايا القاعدية المجزأة ، من بين أشياء أخرى ، وبالتالي سيتم صبغها باللون الأزرق الميثيلين.
في هذا المعنى نفسه ، فإن الهياكل الأساسية للخلايا هي الهيموغلوبين وبعض الحبيبات مثل تلك الموجودة في الحمضات المقسمة ، من بين أشياء أخرى ؛ وسيتم مصبوغ هذه مع eosin.
من ناحية أخرى ، نظرًا لحقيقة أن الميثيلين الأزرق والزرني يتميزان بأصباغ متناظرة ، فيمكنهما توفير نغمة متغيرة للهياكل المختلفة وفقًا لحجم polyanions التي يمتلكانها..
هذه هي الطريقة التي يمكن بها للمزيج الاستراتيجي من الأصباغ الأساسية والحمضية تطوير مجموعة واسعة من الألوان ، وفقًا للخصائص الكيميائية الحيوية لكل هيكل ، والمشي عبر نغمات زرقاء شاحبة ، وأزرق غامق ، وأرجواني وأرجواني في حالة الهياكل الحمضية.
في حين أن اللون الذي توفره eosin أكثر ثباتًا ، إلا أنه يولد ألوانًا بين البرتقالي المحمر وسمك السلمون.
المواد
مواد لإعداد الحل الأم
يتطلب تحضير محلول المخزون وزن 600 ملغ من صبغة جيمسا المسحوقة ، بقياس 500 سم مكعب من كحول الميثيل الخالي من الأسيتون و 50 سم مكعب من الجلسرين المحايد.
وضع الاستعداد للحل الأم
ضع مسحوق Giemsa الثقيل في هاون. إذا كانت هناك كتل ، يجب رشها. تضاف بعد ذلك كمية ملحوظة من الجلسرين المقاس وتخلط جيدًا. يسكب الخليط الناتج في زجاجة كهرمان نظيفة للغاية.
يتم وضع بقية الجلسرين في الهاون. تخلط مرة أخرى لتنظيف الصبغة المتبقية التي كانت عالقة على جدران الهاون وتصب في نفس الزجاجة.
تمت تغطية الزجاجة وحملها لمدة ساعتين في حمام مائي عند 55 درجة مئوية. بينما في الحمام المليء بالماء ، حرك المزيج بخفة كل نصف ساعة أو نحو ذلك.
بعد ذلك ، يُسمح للخليط بالتبريد لوضع الكحول. في السابق ، يتم وضع جزء من الكحول المقاس في الهاون لإنهاء غسل ما تبقى من الصبغة ثم يضاف إلى الخليط مع بقية الكحول.
يجب السماح لهذا المستحضر بالنضوج لمدة أسبوعين على الأقل. يجب تصفية الجزء المستخدم من الحل الأم.
لتجنب تلوث المستحضر ، يوصى بتمرير الجزء الذي سيتم استخدامه بشكل مستمر لزجاجة العنبر الصغيرة مع قطارة. اشحن في كل مرة ينفد الكاشف.
مواد لإعداد الحل العازلة
من ناحية أخرى ، يتم إعداد محلول مؤقت في درجة الحموضة 7.2 على النحو التالي:
يتم وزن 6.77 جرام من فوسفات الصوديوم (اللامائي) (NaHPO)4) ، 2.59 غرام من فوسفات هيدروجين البوتاسيوم (KH)2PO4) والماء المقطر يصل إلى 1000 سم مكعب.
التحضير النهائي للصبغة
لإعداد محلول تلطيخ النهائي ، يتم قياس 2 سم مكعب من محلول المخزون المصفى وخلطها مع 6 سم مكعب من محلول العازلة. يقلب الخليط.
والحقيقة ذات الصلة التي يجب أن تؤخذ في الاعتبار ، هي أن تقنيات إعداد الصبغة يمكن أن تتغير وفقا للمنزل التجاري.
المواد الإضافية اللازمة لأداء التلوين
بصرف النظر عن المواد الموصوفة ، ينبغي تزويدها بجسور ملونة أو شاشات مائية أو عازلة للغسيل أو ملاءات للأشياء أو الأغطية أو ساعة توقيت للتحكم في أوقات التلوين ونشاف الورق أو بعض المواد التي يمكن استخدامها لتجفيفها ( الشاش أو القطن).
تقنية
عملية تلطيخ
1) قبل التلوين ، يجب أن يكون لديك عينة تنتشر على شريحة نظيفة..
يمكن أن تكون العينات هي الدم أو النخاع العظمي أو جروح الأنسجة النسيجية أو عينات عنق الرحم المهبلية. من المستحسن أن تكون النهايات الخارجية رقيقة ولها ساعة أو ساعتين من التجفيف قبل تلوينها.
2) يتم وضع جميع الأوراق التي يجب تلوينها على جسر ملون. اعمل دائمًا بنفس الترتيب وحدد كل ورقة جيدًا.
3) ضع بضع قطرات من ميثيل الكحول (الميثانول) بنسبة 100 ٪ على اللطاخ واتركه لمدة 3 إلى 5 دقائق ، من أجل إصلاح وتجفيف العينة.
4) تجاهل الميثانول الموجود في ورقة والسماح للهواء الجاف.
5) بمجرد التجفيف ، ضع محلول تلطيخ نهائي مع قطارة حتى تتم تغطية الورقة بأكملها. اتركيه لمدة 15 دقيقة. يوصي بعض المؤلفين بحد أقصى 25 دقيقة. يعتمد على المنزل التجاري.
6) قم بتصريف الصبغة وغسل اللطخة بالماء المقطر أو بمحلول 7.2 فاصل.
7) على ورقة النشاف ، دع الأوراق تجف في الهواء الطلق ، مرتبة رأسياً بمساعدة دعامة.
8) امسح الجزء الخلفي من الشريحة بشاش أو قطعة قطن مبللة بالكحول لإزالة أي صبغة متبقية.
خدمات
يتم استخدام تقنية تلطيخ Giemsa في العديد من المجالات ، بما في ذلك: أمراض الدم ، الفطريات ، علم الجراثيم ، الطفيليات ، علم الخلايا وعلم الوراثة الخلوية.
مبحث الدم
هذا هو الأداة الأكثر شيوعا التي تعطى لهذا تلطيخ. مع ذلك ، يمكننا تحديد كل واحدة من الخلايا الموجودة في عينات من نخاع العظام أو الدم المحيطي. بالإضافة إلى تقدير عدد كل سلسلة ، والقدرة على اكتشاف عدد الكريات البيضاء أو قلة الكريات البيض ، قلة الصفيحات ، إلخ..
نظرًا لأنها حساسة لتحديد الخلايا غير الناضجة ، فهي ذات صلة بتشخيص سرطان الدم الحاد أو المزمن. من الممكن أيضًا تشخيص فقر الدم ، مثل مرض فقر الدم المنجلي ، أو مرض فقر الدم المنجلي ، وغيرها..
علم الفطريات
في هذا المجال ، من الشائع استخدامه للبحث عنه هستوبلازما كبسولات (الفطريات ثنائي الشكل داخل الخلايا) في عينات الأنسجة.
علم الجراثيم
في المسحات الدموية ملطخة بـ Giemsa ، يمكن اكتشافها بوريلياس س في المرضى الذين يعانون من مرض يسمى الحمى المتكررة. توجد كرات spirochetes بين كريات الدم الحمراء ، في عينات مأخوذة في ذروة الحموية.
ومن الممكن ايضا تصور البكتيريا داخل الخلايا Rickettsias sp و الكلاميديا الحثرية في الخلايا المصابة.
علم الطفيليات
في مجال الطفيليات ، سمح تلطيخ جيمسا بتشخيص الأمراض الطفيلية مثل الملاريا ومرض شاغاس وداء الليشمانيات..
في أول اثنين من الطفيليات Plasmodium sp و داء المثقبيات كروز على التوالي ، يمكن تصورها في الدم المحيطي للمرضى المصابين ، ويمكن العثور عليها في مراحل مختلفة وفقا للمرحلة التي يكون فيها المرض.
لتحسين البحث عن طفيليات الدم ، يوصى باستخدام صبغة Giemsa الممزوجة بصبغة May-Grünwald.
وبالمثل ، يمكن تشخيص داء الليشمانيات الجلدي عند تقييم عينات من خزعات الجلد الملطخة بـ Giemsa ، حيث يوجد الطفيل..
علم الخلايا
يستخدم تلطيخ Giemsa أيضًا في الدراسة الخلوية لعينات باطن عنق الرحم ، على الرغم من أنها ليست الطريقة الأكثر استخدامًا لهذا الغرض.
ولكن في حالات ندرة الموارد ، يمكن استخدام وظائف مماثلة لتلك التي توفرها تقنية Papanicolaou وبتكلفة أقل. ومع ذلك ، فإنه يتطلب خبرة من جانب الفاحص.
علم الوراثة الخلوية
من السمات ذات الصلة في تلطيخ Giemsa هي قدرتها على الارتباط بقوة بالمناطق الغنية بأدينينات الحمض النووي والسمك. يسمح هذا لتصور الحمض النووي أثناء انقسام الخلايا ، في حالات تكاثف مختلفة.
هذه الدراسات ضرورية للكشف عن الانحرافات اللونية مثل الازدواجية أو الحذف أو الإزاحة في مناطق الكروموسومات المختلفة.
بحث يوضح فعالية تلطيخ جيمسا
Cannova et al (2016) ، مقارنة 3 تقنيات تلوين لتشخيص داء الليشمانيات الجلدي.
لهذا ، استخدموا عينات تم الحصول عليها من حيوان تجريبي (Mesocrisetus auratus) تلقيح تجريبيًا مع الليشمانيات.
أظهر المؤلفون أن تلطيخ Giemsa كان أفضل من Pap-mart® و Gaffney تلطيخ. لذلك ، اعتبروا أن وصمة جيمسا مثالية لتشخيص داء الليشمانيات الجلدي.
إن النتائج الممتازة التي حصل عليها المؤلفون ترجع إلى حقيقة أن مزيج الأصباغ التي تشكل خليط Giemsa يقدم الظروف اللازمة لخلق تباين إيجابي ، مما يسمح بالتمييز الواضح للهياكل العقيمة ، سواء داخل أو خارج الخلية..
التقنيات الأخرى (Pap-mart® و Gaffney) فعلت ذلك أيضًا ، ولكن بطريقة أضعف وبالتالي يصعب تصورها. لهذا السبب يوصى بصمة جيمسا للتشخيص الطفيلي لداء الليشمانيات.
وبالمثل ، قامت دراسة أجراها راميريز وآخرون (1994) ، بتقييم صلاحية بقع غيمسا وليندروم في اللطاخات الملتحمة لتحديد الكلاميديا الحثرية.
قرر المؤلفون أن تلطيخ Giemsa و Ledrum لهما نفس الخصوصية ، لكن Giemsa كان أكثر حساسية.
هذا ما يفسر السبب في أن تلطيخ Giemsa حاليًا هو الأكثر استخدامًا لتشخيص الالتهابات الكلاميدية ، خاصةً إذا كانت الموارد قليلة.
توصيات ل تلطيخ جيد
لا ينبغي تسريع تجفيف الأوراق. يجب انتظار وقت الحيطة لتجفيفه في الهواء الطلق. حوالي 2 ساعة.
اللون مباشرة بعد 2 ساعة للحصول على أفضل النتائج.
لكي تكون المسحات مثبتة وملطخة بشكل أفضل ، يجب توزيع العينة على الورقة بحيث تبقى طبقة رقيقة وموحدة..
عينة الدم المفضلة هي الشعيرات الدموية ، حيث يتم إجراء اللطاخة مباشرةً من قطرة الدم وبالتالي لا تحتوي العينة على مادة مضافة ، مما يدعم الحفاظ على هياكل الخلية.
ومع ذلك ، إذا تم استخدام الدم الوريدي ، فيجب استخدام EDTA كمضاد للتخثر وليس الهيبارين ، لأن الأخير عادة ما يشوه الخلايا.
الأخطاء الشائعة في تلوين جيمسا
في ممارسة هذا التلوين ، يمكن ارتكاب أخطاء. يتضح من التغييرات المفاجئة في ظلال الهياكل.
التلوين الأزرق للغاية
يمكن أن يكون بسبب:
- مسحات سميكة جدا
- تجاوز الوقت تلطيخ
- القليل جدا من الغسيل.
- استخدام الكواشف أعلى بكثير من الرقم الهيدروجيني المحايد (القلوية).
في ظل هذه الظروف ، يتم تشويه ألوان الهياكل التالية ، بحيث تبدو كريات الدم الحمراء بدلاً من الموت السلمون الوردي ، وحبيبات الحمضات التي ينبغي صبغها من الطوب الأحمر سوف تتحول إلى اللون الأزرق أو الرمادي الانحراف بالطن المعتاد.
تلوين وردي بشكل مفرط
قد يكون بسبب:
- عدم كفاية الوقت تلطيخ.
- الغسيل المطول أو المفرط.
- سوء التجفيف.
- استخدام الكواشف الحمضية للغاية.
في هذه الحالة بالذات ، لن تكون الهياكل ذات اللون الأزرق عادة ظاهرة للعيان ، في حين أن الهياكل ذات اللون الوردي ستكون ذات ألوان مبالغ فيها للغاية.
مثال: سوف تأخذ كريات الدم الحمراء لونًا أحمر فاتحًا أو برتقاليًا قويًا ، وسيظهر اللون الكروماتين النووي بلون وردي باهت وستصبح حبيبات الحمضات حمراء زاهية..
وجود رواسب في اللطاخة
يمكن أن تكون الأسباب:
- استخدام الأوراق القذرة أو سيئة غسلها.
- لا تدع المسحة تجف جيدًا.
- اترك حل التثبيت لفترة طويلة جدًا.
- الغسيل غير كافية في نهاية تلطيخ.
- عدم كفاية الترشيح أو عدم ترشيح الصبغة المستخدمة.
وجود القطع الأثرية
قد تظهر الآثار المورفولوجية في اللطاخات ، مما يجعل من الصعب تصور الهياكل الموجودة وتفسيرها. هذا بسبب:
- نوع من مضادات التخثر المستخدمة ، مثل الهيبارين.
- استخدام الأوراق القذرة أو التالفة أو الدهنية.
وضع التخزين
بعد التحضير ، يجب أن تظل الصبغة في درجة حرارة الغرفة (15-25 درجة مئوية) ، لمنع الصباغ من الترسيب. يجب أن يتم تخزينها في حاوية العنبر مغلقة.
مراجع
- Cannova D، Brito E and Simons M. تقييم تقنيات التلوين لتشخيص داء الليشمانيات الجلدي. سالوس. 2016؛ 20 (2): 24-29.
- PanReac Applichem ITW الكواشف. غيمسا وصمة عار. الإصدار 2: JMBJUL17 CEIVD10ES. كاستلار ديل فاليس ، أسبانيا.
- Clark G. Staining procedures (1981)، 4thed. ويليامز وويلكنز.
- الكيمياء السريرية التطبيقية Giemsa صبغ للتشخيص في المختبر. الموزع: cromakit.es
- Ramírez I و Mejía M و García de la Riva J و Hermes F و Grazioso C. صلاحية بقع Giemsa و Lendrum في مسحات الملتحمة لتحديد الكلاميديا الحثرية. بول سانيت بانام. 1994؛ 116 (3): 212-216.
- Casas-Rincon G. Mycology General. 1994. الطبعة الثانية ، جامعة فنزويلا المركزية ، إصدارات المكتبة. فنزويلا ، كاراكاس.
- "غيمسا وصمة عار." ويكيبيديا ، الموسوعة الحرة. 1 سبتمبر 2017 ، 01:02 UTC. 6 ديسمبر 2018 ، en.wikipedia.org.


